« Fizikë - klasa 10 "
Gjendja e të cilit gazi përshkruhet me ekuacionin Mendeleev-Klapeyron.
A mund të konsiderohet një konstante universale e gazit një konstante themelore?
Duke përdorur ekuacionin e gjendjes për një gaz ideal, është e mundur të studiohen proceset në të cilat masa e gazit dhe një nga tre parametrat - presioni, vëllimi ose temperatura - mbeten të pandryshuara.
Marrëdhëniet sasiore midis dy parametrave të gazit me një vlerë fikse të të tretës quhen ligjet e gazit.
Quhen proceset që vazhdojnë me një vlerë konstante të njërit prej parametrave izoproceset.
Fjala "izoproces" është një fjalë komplekse, pjesa e parë e së cilës vjen nga fjala greke isos - e barabartë, e njëjtë.
Vini re se në realitet asnjë proces nuk mund të vazhdojë me një vlerë rreptësisht fikse të ndonjë parametri. Gjithmonë ka ndikime të caktuara që shkelin qëndrueshmërinë e temperaturës, presionit ose vëllimit. Vetëm në kushte laboratorike është e mundur të ruhet qëndrueshmëria e një ose një tjetër parametri me saktësi të lartë, por në funksionimin e pajisjeve teknike dhe në natyrë kjo është praktikisht e pamundur. Një izoproces është një model i idealizuar i një procesi real që vetëm përafërsisht pasqyron realitetin.
Procesi izotermik.
Procesi i ndryshimit të gjendjes së një sistemi trupash makroskopikë (sistemi termodinamik) në një temperaturë konstante quhet izotermike.
Fjala "izotermale" vjen nga fjalët greke isos - e barabartë, e barabartë dhe therme - ngrohtësi.
Për të mbajtur konstante temperaturën e gazit, është e nevojshme që ai të mund të shkëmbejë nxehtësi me një sistem të madh - një termostat. Përndryshe, temperatura e gazit do të ndryshojë gjatë ngjeshjes ose zgjerimit. Ajri atmosferik mund të shërbejë si termostat nëse temperatura e tij nuk ndryshon dukshëm gjatë gjithë procesit. Sipas ekuacionit të gjendjes së një gazi ideal (10.4), nëse masa e gazit nuk ndryshon, në çdo gjendje me temperaturë konstante, produkti i presionit të gazit dhe vëllimit të tij mbetet konstant:
pV = konstacion në T = konst. (10.6)
Ky përfundim u arrit nga shkencëtari anglez R. Boyle (1627-1691) dhe pak më vonë nga shkencëtari francez E. Mariotte (1620-1684) mbi bazën e një eksperimenti. Prandaj, mban emrin Ligji Boyle-Mapuott.
Për një gaz të një mase të caktuar, produkti i presionit të gazit dhe vëllimit të tij është konstant.
Ligji i Boyle-Mariotte është zakonisht i vlefshëm për çdo gaz, si dhe për përzierjet e tyre, për shembull, për ajrin. Vetëm në presione disa qindra herë më të larta se ato atmosferike, devijimet nga ky ligj bëhen të rëndësishme.
Kurba që përshkruan varësinë e presionit të gazit nga vëllimi në temperaturë konstante quhet izotermike.
Izotermia e gazit përshkruan marrëdhënien e kundërt midis presionit dhe vëllimit. Një kurbë e këtij lloji në matematikë quhet hiperbolë(fig.10.1).
Izoterma të ndryshme korrespondojnë me temperatura të ndryshme konstante. Me rritjen e temperaturës së gazit, presioni sipas ekuacionit të gjendjes (10.4) rritet nëse V = konst. Prandaj, izotermia që korrespondon me temperaturën më të lartë T 2 qëndron mbi izotermën që korrespondon me temperaturën më të ulët T 1 (shih Fig. 10.1).
Që procesi të zhvillohet në një temperaturë konstante, ngjeshja ose zgjerimi i gazit duhet të jetë shumë i ngadaltë. Fakti është se, për shembull, kur kompresohet, gazi nxehet, pasi kur pistoni lëviz në enë, shpejtësia dhe, rrjedhimisht, energjia kinetike e molekulave pas goditjeve kundër pistonit rritet, dhe, rrjedhimisht, gazi rritet edhe temperatura. Kjo është arsyeja pse, për të zbatuar procesin izotermik, është e nevojshme, pas një zhvendosjeje të lehtë të pistonit, të prisni derisa temperatura e gazit në enë të bëhet përsëri e barabartë me temperaturën e ajrit të ambientit.
Për më tepër, vërejmë se me kompresim të shpejtë, presioni nën piston bëhet menjëherë më i madh se në të gjithë anijen. Nëse vlerat e presionit dhe temperaturës në pika të ndryshme të vëllimit janë të ndryshme, atëherë në këtë rast gazi është në gjendje joekuilibri dhe nuk mund të emërtojmë vlerat e temperaturës dhe presionit që përcaktojnë në ky moment gjendjen e sistemit. Nëse sistemi lihet në vetvete, atëherë temperatura dhe presioni gradualisht barazohen, sistemi vjen në një gjendje ekuilibri.
Gjendja e ekuilibrit- kjo është një gjendje në të cilën temperatura dhe presioni në të gjitha pikat e vëllimit janë të njëjta.
Parametrat e gjendjes së një gazi mund të përcaktohen nëse ai është në ekuilibër.
Procesi në të cilin të gjitha gjendjet e ndërmjetme të gazit janë në ekuilibër quhet procesi i ekuilibrit.
Natyrisht, në grafikët e varësisë së një parametri nga një tjetër, ne mund të përshkruajmë vetëm proceset e ekuilibrit.
Procesi izobarik
Procesi i ndryshimit të gjendjes së një sistemi termodinamik me presion konstant quhet izobarike.
Fjala "izobarike" vjen nga fjalët greke isos - i barabartë, i njëjtë dhe baros - peshë, peshë.
Sipas ekuacionit (10.4) në çdo gjendje të gazit me presion konstant, raporti i vëllimit të gazit me temperaturën e tij mbetet konstant:
Ky ligj u vendos eksperimentalisht në vitin 1802 nga shkencëtari francez J. Gay-Lussac (1778-1850) dhe quhet Ligji Gay Lussac.
Ligji i Gay Lussac:
Për një gaz të një mase të caktuar me presion konstant, raporti i vëllimit me temperaturën absolute është konstant.
Sipas ekuacionit (10.7), vëllimi i gazit në presion konstant është proporcional me temperaturën:
V = konst T. (10.8)
Vija e drejtë që përshkruan varësinë e vëllimit të gazit nga temperatura në presion konstant quhet izobarike.
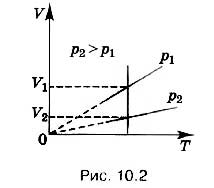
Izobare të ndryshme i përgjigjen presioneve të ndryshme (Fig. 10.2). Le të vizatojmë një izotermi arbitrare në figurë. Me rritjen e presionit, vëllimi i gazit në një temperaturë konstante zvogëlohet sipas ligjit Boyle-Mariotte. Prandaj, izobari që korrespondon me presionin më të lartë p 2 qëndron poshtë izobarit që korrespondon me presionin më të ulët p 1.
Në zonën e temperaturat e ulëta të gjitha izobaret ideale gazi konvergojnë në pikën T = 0. Por kjo nuk do të thotë se vëllimi reale gazi zhduket. Të gjithë gazrat me ftohje të fortë shndërrohen në lëngje, dhe ekuacioni i gjendjes (10.4) është i pazbatueshëm për lëngjet. Kjo është arsyeja pse, duke u nisur nga një vlerë e caktuar e temperaturës, varësia e vëllimit nga temperatura vizatohet në grafik me një vijë të ndërprerë. Në fakt, një substancë në gjendje të gaztë nuk mund të ketë vlera të tilla të temperaturës dhe presionit.
Procesi izokorik
Procesi i ndryshimit të gjendjes së një sistemi termodinamik në një vëllim konstant quhet izokorik.
Fjala "izokorik" vjen nga fjalët greke isos - i barabartë, i njëjtë dhe chora - një vend, një hapësirë e zënë nga diçka.
Nga ekuacioni i gjendjes (10.4) rezulton se në çdo gjendje të një gazi me vëllim konstant, raporti i presionit të gazit ndaj temperaturës së tij mbetet konstant:
Ky ligj i gazit u krijua në 1787 nga fizikani francez J. Charles (1746-1823) dhe quhet Ligji i Charles.
Për një gaz të një mase të caktuar, raporti i presionit ndaj temperaturës absolute është konstant nëse vëllimi nuk ndryshon.
Sipas ekuacionit (10.9), presioni i gazit në vëllim konstant është proporcional me temperaturën:
p = konst T. (10.10)
Vija e drejtë që përshkruan varësinë e presionit të gazit nga temperatura në një vëllim konstant quhet izokore.
Izokore të ndryshme korrespondojnë me vëllime të ndryshme. Vizatojmë edhe një izotermi arbitrare në figurë (Fig. 10.3). Me një rritje të vëllimit të gazit në një temperaturë konstante, presioni i tij, sipas ligjit Boyle-Mariotte, zvogëlohet. Prandaj, izokora që korrespondon me vëllimin më të madh V 2 shtrihet poshtë izokorit që korrespondon me vëllimin më të vogël V 1.
Në përputhje me ekuacionin (10.10), të gjitha izokoret e një gazi ideal fillojnë në pikën T = 0. Prandaj, presioni i një gazi ideal në zero absoluteështë e barabartë me zero.
Një rritje e presionit të gazit në çdo enë ose në një llambë elektrike gjatë ngrohjes mund të konsiderohet një proces izokorik. Procesi izokorik përdoret në termometrat e gazit me vëllim konstant.
Si përfundim, ne do të hartojmë një qark referencë (Fig. 10.4) dhe do të tregojmë tranzicionet logjike që lidhin ligje dhe ekuacione të ndryshme.
2. Bazat e termodinamikës
2.01. Në presion konstant p, vëllimi i gazit do të rritet me ∆V. Çfarë sasie fizike është e barabartë me produktin p | ∆V | në këtë rast?
A.) punë e bërë me gaz;
B.) puna e kryer në gaz nga forcat e jashtme;
B.) sasia e nxehtësisë së marrë nga gazi;
G.) energjia e brendshme e gazit.
2.02. Puna A është bërë në trup nga forcat e jashtme dhe sasia e nxehtësisë Q është bartur në trup.Cili është ndryshimi i energjisë së brendshme ∆U të trupit?
A.) ∆U = A; B.) ∆U = Q B.) ∆U = A + Q; D.) ∆U = A-Q; D.) ∆U = Q-A.
2.03. Çfarë procesi ka ndodhur në një gaz ideal nëse ndryshimi i energjisë së brendshme të tij është i barabartë me zero?
A.) izobarike; B.) izotermike; B.) izokorik; G.) adiabatike.
2.04. Një sasi nxehtësie bartet në një gaz ideal në atë mënyrë që në çdo moment të kohës sasia e transferuar e nxehtësisë Q të jetë e barabartë me punën A që kryen gazi. Çfarë procesi po kryhet?
A.) adiabatike; B.) izobarike; B.) izokorik; G.) izotermike.
2.05. Cila sasi fizike llogaritet me formulë?
A.) sasia e nxehtësisë në një gaz ideal;
B.) presioni ideal i gazit;
C.) energjia e brendshme e një gazi ideal monatomik;
G.) energjia e brendshme e një moli të një gazi ideal.
2.06. Ndër formulat e mëposhtme, gjeni atë që llogarit efikasitetin maksimal të motorit të nxehtësisë.
A.) 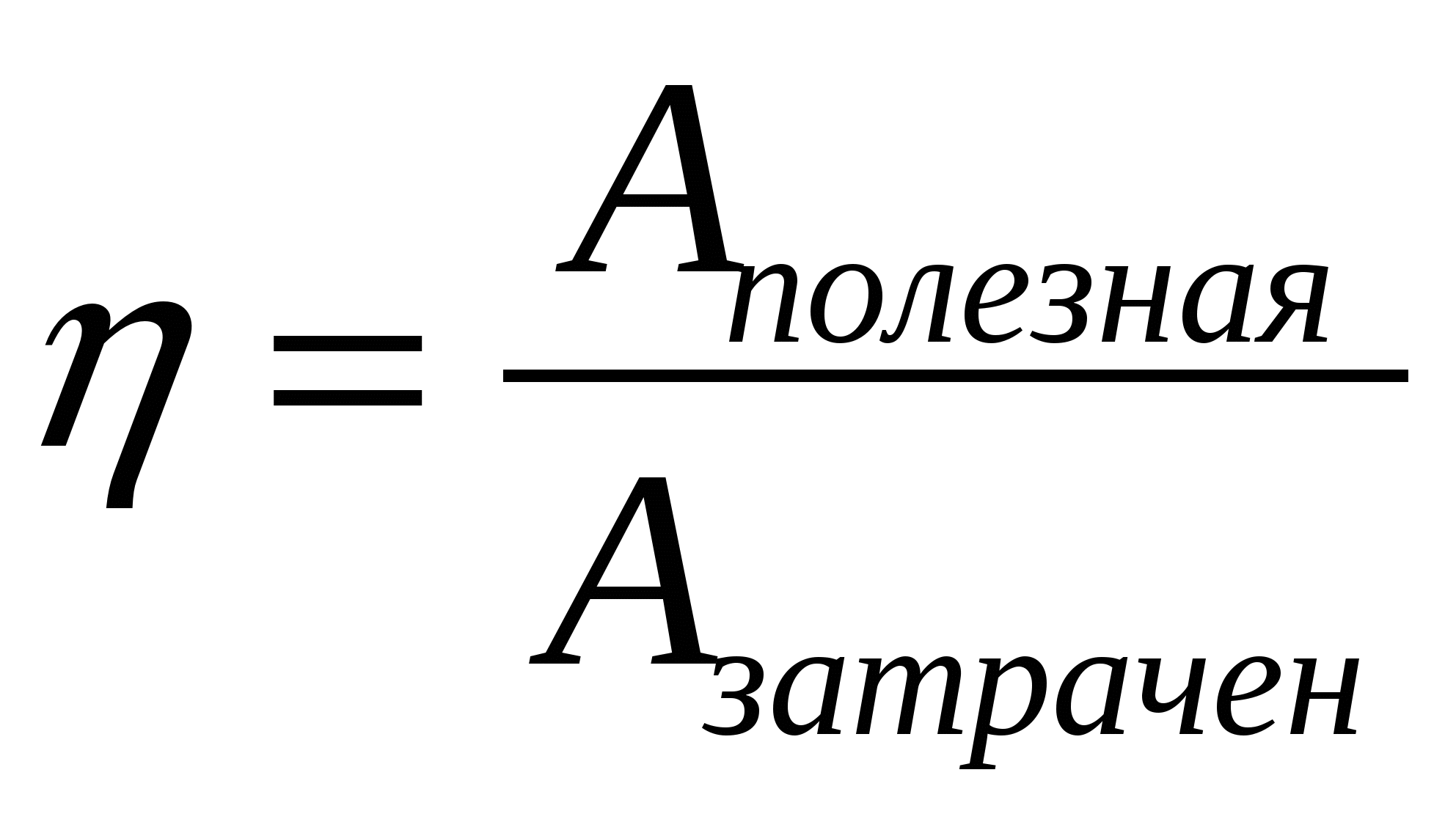 ; B.)
; B.)  ; V.)
; V.) 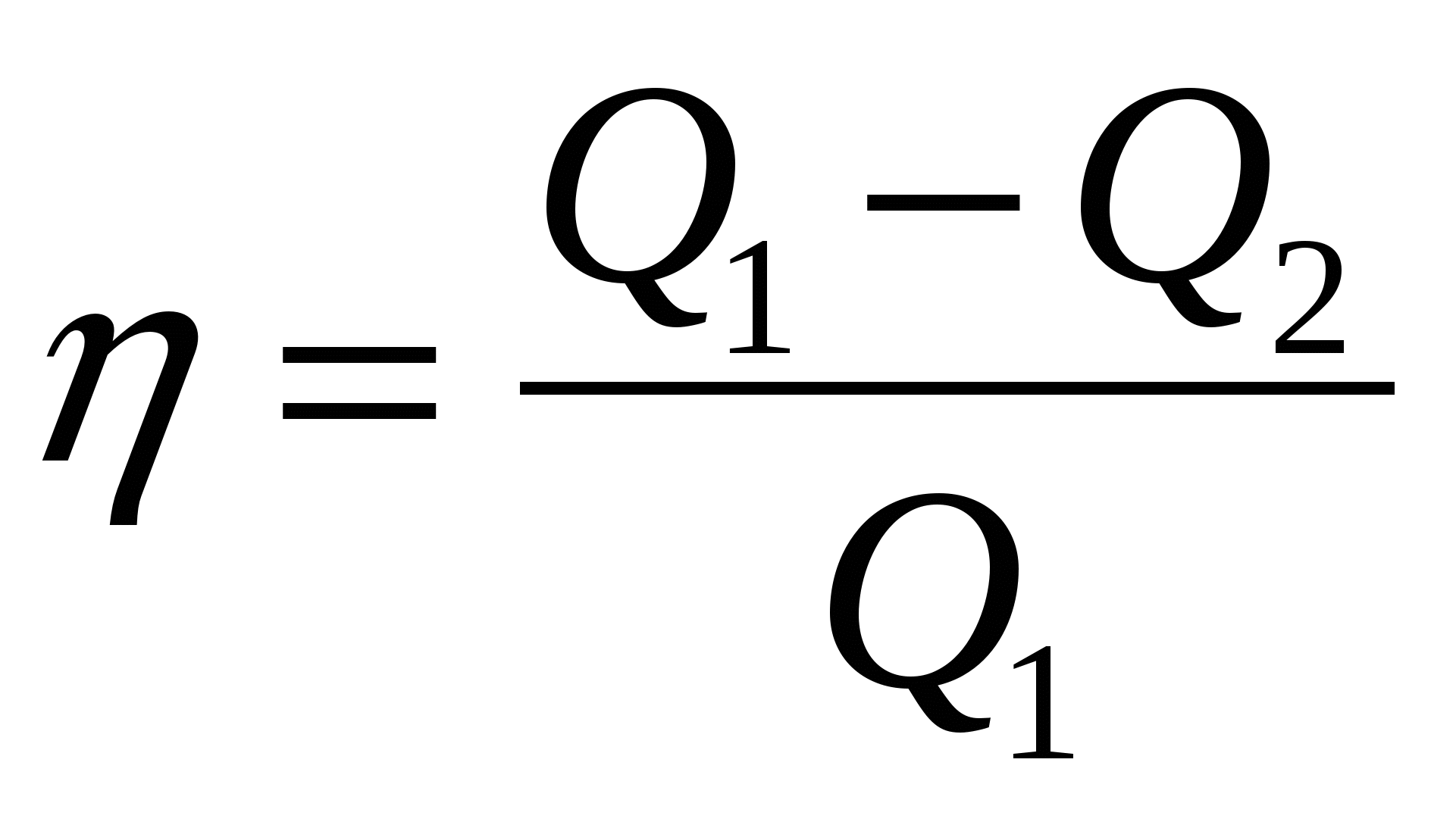 ; G.)
; G.)  .
.
2.07. Çfarë procesi ka ndodhur në një gaz ideal, nëse ndryshimi i energjisë së brendshme të tij është i barabartë me sasinë e nxehtësisë së furnizuar?
A.) izobarike; B.) izotermike; B.) izokorik; G.) adiabatike.
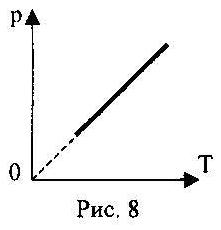 2.08. Figura 8 tregon një grafik të izoprocesit me një gaz ideal. Shkruani ligjin e parë të termodinamikës për të.
2.08. Figura 8 tregon një grafik të izoprocesit me një gaz ideal. Shkruani ligjin e parë të termodinamikës për të.
A.) ∆U = Q + A /;
B.) ∆U = A /;
2 .09. Në fig. 9 tregon grafikët e adiabatit dhe izotermës për një masë të caktuar gazi. Cila nga këto dy kthesa është adiabat?
.09. Në fig. 9 tregon grafikët e adiabatit dhe izotermës për një masë të caktuar gazi. Cila nga këto dy kthesa është adiabat?
A.) 1 - adiabat, 2 - izotermi;
B.) 1 - izotermi, 2 - adiabat;
B.) nuk ka përgjigje të saktë.
2.10. Me ngjeshjen e shpejtë të gazit në cilindër, temperatura e tij u rrit. A do të ndryshojë energjia e brendshme e gazit në këtë rast? Shkruani ekuacionin e ligjit të parë të termodinamikës për këtë rast.
A.) energjia është zvogëluar Q = ∆U + A /;
B.) energjia është rritur ∆U = -A /;
B.) energjia nuk ka ndryshuar Q = A /.
2.11. Përcaktoni energjinë e brendshme të dy moleve të një gazi monatomik (ideal) të marrë në një temperaturë prej 300 K.
A.) 2,5 kJ; B.) 2,5 J; B.) 4,9 J; G.) 4,9 kJ; D.) 7,5 kJ.
2.12. Cili është ndryshimi në energjinë e brendshme të një mol të një gazi monatomik ideal nëse T 1 = T dhe T 2 = 2T?
A.) RT; B.) 2RT; B.) 3RT; G.) 1,5 RT.
2.13. Çfarë pune bën gazi, duke u zgjeruar në mënyrë izobarike me presion 2 ∙ 10 5 Pa nga vëllimi V 1 = 0,1 m 3 në vëllimin V 2 = 0,2 m 3?
A.) 2 ∙ 10 6 J; B.) 200 kJ; B.) 0,2 ∙ 10 5 J.
2.14. Një sasi nxehtësie e barabartë me 2000 J u transferua në sistemin termodinamik dhe në të u punua me 500 J. Përcaktoni ndryshimin e energjisë së tij të brendshme të këtij sistemi.
A.) 2500 J; B.) 1500 J; B.) ∆U = 0.
2.15. Në dhomë, si rezultat i djegies së karburantit, lirohet një energji e barabartë me 600 J dhe frigoriferi merrte një energji të barabartë me 400 J. Çfarë pune bënte motori?
A.) 1000 J; B.) 600 J; V.) 400 J; G.) 200 J.
2.16. Me ngrohjen izobarike të një mase të caktuar oksigjeni në ΔТ = 160 K, u krye një punë prej 8,31 J për të rritur vëllimin e tij. Përcaktoni masën e oksigjenit nëse M = 3,2 ∙ 10 -2 kg / mol, R = 8,31 J / (K ∙ mol).
A.) 0,2 kg; B.) 2 kg; B.) 0,5 kg; G.) 0,2 g.
2.17. Sa është efikasiteti maksimal i një motori me nxehtësi që përdor një ngrohës me temperaturë 427 0 С dhe një frigorifer me temperaturë 27 0 С?
A.) 40%; B.) 6%; B.) 93%; G.) 57%.
2.18. Temperatura e ngrohësit të një motori ideal me nxehtësi është 425 K, dhe temperatura e frigoriferit është 300 K. Motori merr 4 ∙ 10 4 J nxehtësi nga ngrohësi. Llogaritni punën e bërë nga lëngu punues i motorit.
A.) 1,2 ∙ 10 4 J; B.) 13,7 ∙ 10 4 J; V.) është e pamundur të llogaritet puna.
2.19. Në cilindër nën piston ka ajër, me peshë 29 kg. Çfarë pune do të bëjë ajri gjatë zgjerimit izobarik nëse temperatura e tij është rritur me 100 K. Mos e merrni parasysh masën e pistonit.
A.) 831 J; B.) 8,31 kJ; B.) 0,83 MJ.
2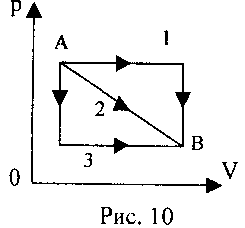 .njëzet. Një gaz ideal kalon nga gjendja A në gjendjen B (shih Fig. 10) në tre mënyra të ndryshme. Kur ishte puna me gaz në maksimum?
.njëzet. Një gaz ideal kalon nga gjendja A në gjendjen B (shih Fig. 10) në tre mënyra të ndryshme. Kur ishte puna me gaz në maksimum?
2.21. Nga cila lartësi ka rënë pjesa e akullit nëse ngrohet me 1 K? Konsideroni se 60% e energjisë së tij potenciale shpenzohet për ngrohjen e një pjese akulli.
A.) 350 m; B.) 700 M; B.) 210 m.
2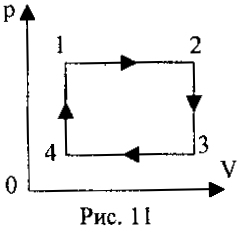 .22. Në fig. 11 përshkruan një proces rrethor të një mase të caktuar të një gazi ideal. Tregoni në cilat faza gazi mori nxehtësi.
.22. Në fig. 11 përshkruan një proces rrethor të një mase të caktuar të një gazi ideal. Tregoni në cilat faza gazi mori nxehtësi.
A.) 1-2 dhe 2-3;
B.) 3-4 dhe 4-1;
B.) 1-2 dhe 4-1;
G.) 2-3 dhe 3-4.
2.23. Një gaz në një sasi prej 1 mol krijon një cikël të përbërë nga 2 izokore dhe 2 izobare. Vëllimi më i vogël i gazit është 10 litra, më i madhi është 20 litra. Presioni më i ulët është 2.5 atm, më i larti është 5 atm. Gjeni punë për cikël.
A.) 2,5 kJ; B.) 5 kJ; B.) 100 kJ; G.) 2,5 J.
2.24. Neoni, i cili ndodhej në kushte normale në një enë të mbyllur me kapacitet 20 litra, u fto me 91 K. Gjeni ndryshimin e energjisë së brendshme të gazit dhe sasisë së nxehtësisë që i jepet.
A.) 1 MJ; B.) 0,6 kJ; B.) 1,5 kJ; G.) 1 kJ.
2.25. Gazi përfundon ciklin Carnot. Temperatura absolute e ngrohësit është 3 herë më e lartë temperaturë absolute frigorifer. Përcaktoni përqindjen e nxehtësisë që i jepet frigoriferit.
A.) 1/2; B.) 1/3; B.) 1/5; G.) 2/3.
2.26. Gazi përfundon ciklin Carnot. Temperatura e ngrohësit T 1 = 380 K, frigoriferi T 2 = 280 K. Sa herë do të rritet efikasiteti i ciklit nëse temperatura e ngrohësit rritet me ∆T = 200 K.
A.) 2 herë; B.) 3 herë; B.) me 1,5 herë; G.) 2.5 herë.
2.27. Tre topa të së njëjtës masë - bakri, çeliku dhe hekuri - bien nga e njëjta lartësi mbi dyshemenë me pllaka. Cila nxehet më shumë temperaturë të lartë... Nxehtësia specifike e bakrit 400 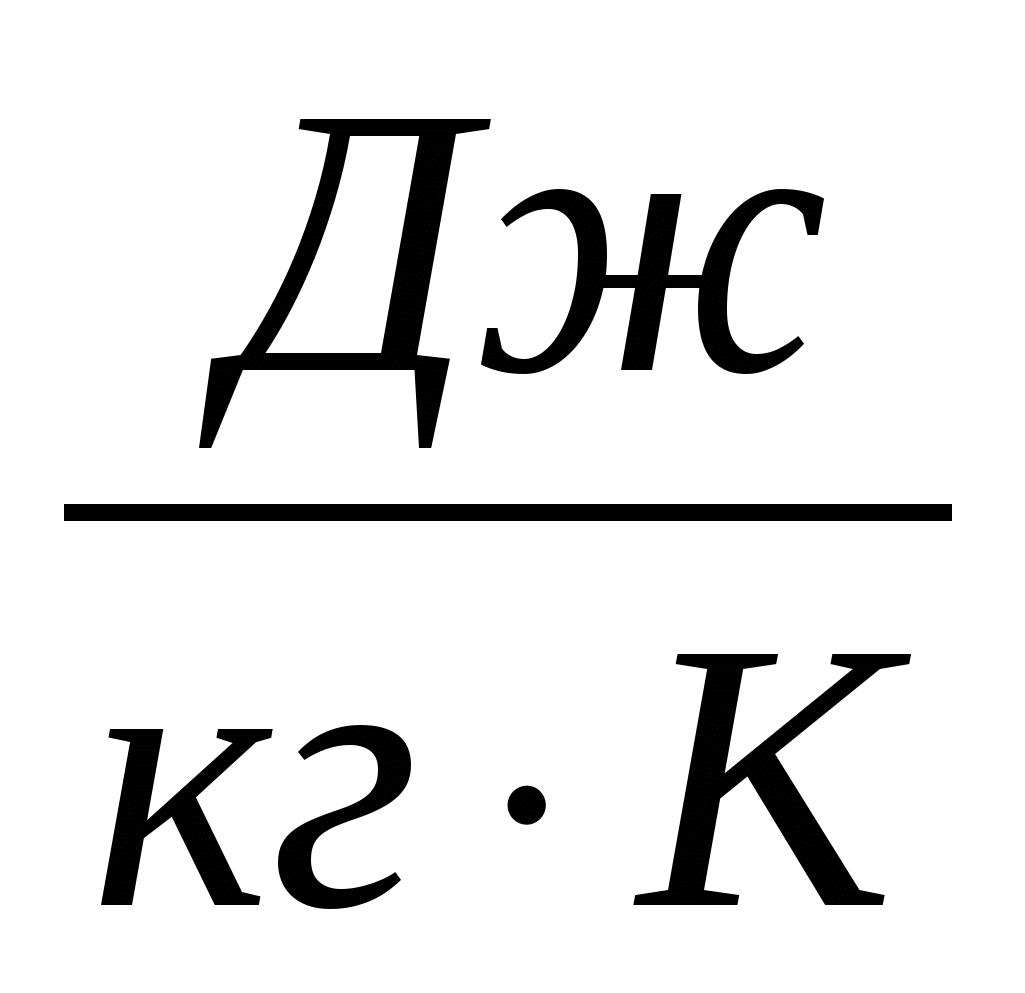 , hekur 460 dhe çelik 500.
, hekur 460 dhe çelik 500.
A.) bakër; B.) çeliku; V.) hekuri.
2.28. Gazi ideal zgjerohet me ligj 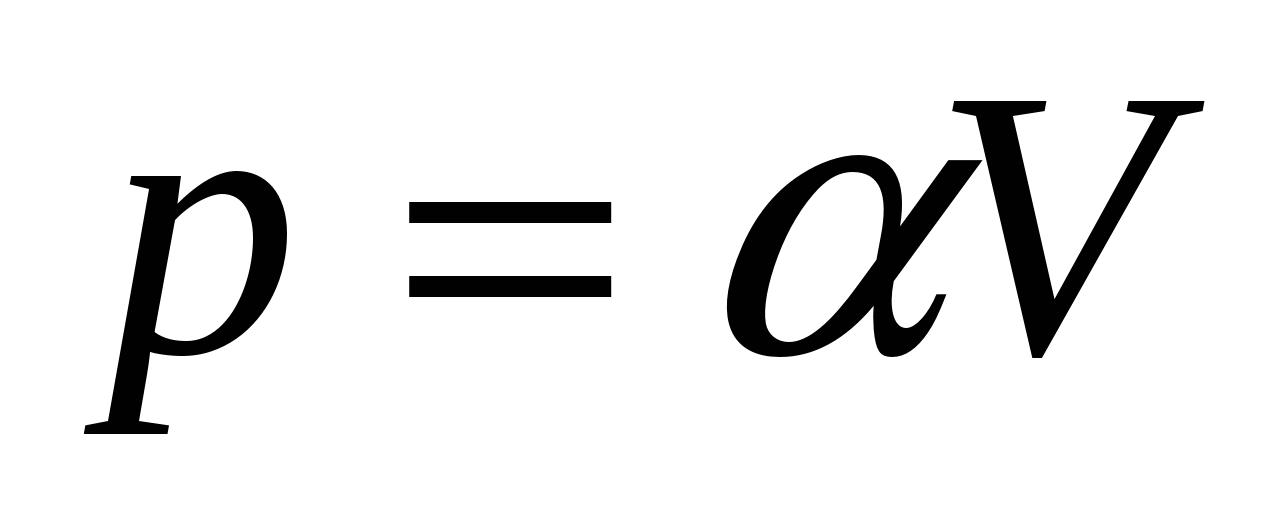 ... Gjeni grafikisht punën e bërë nga gazi ndërsa vëllimi rritet nga V 1 në V 2.
... Gjeni grafikisht punën e bërë nga gazi ndërsa vëllimi rritet nga V 1 në V 2.
A.) 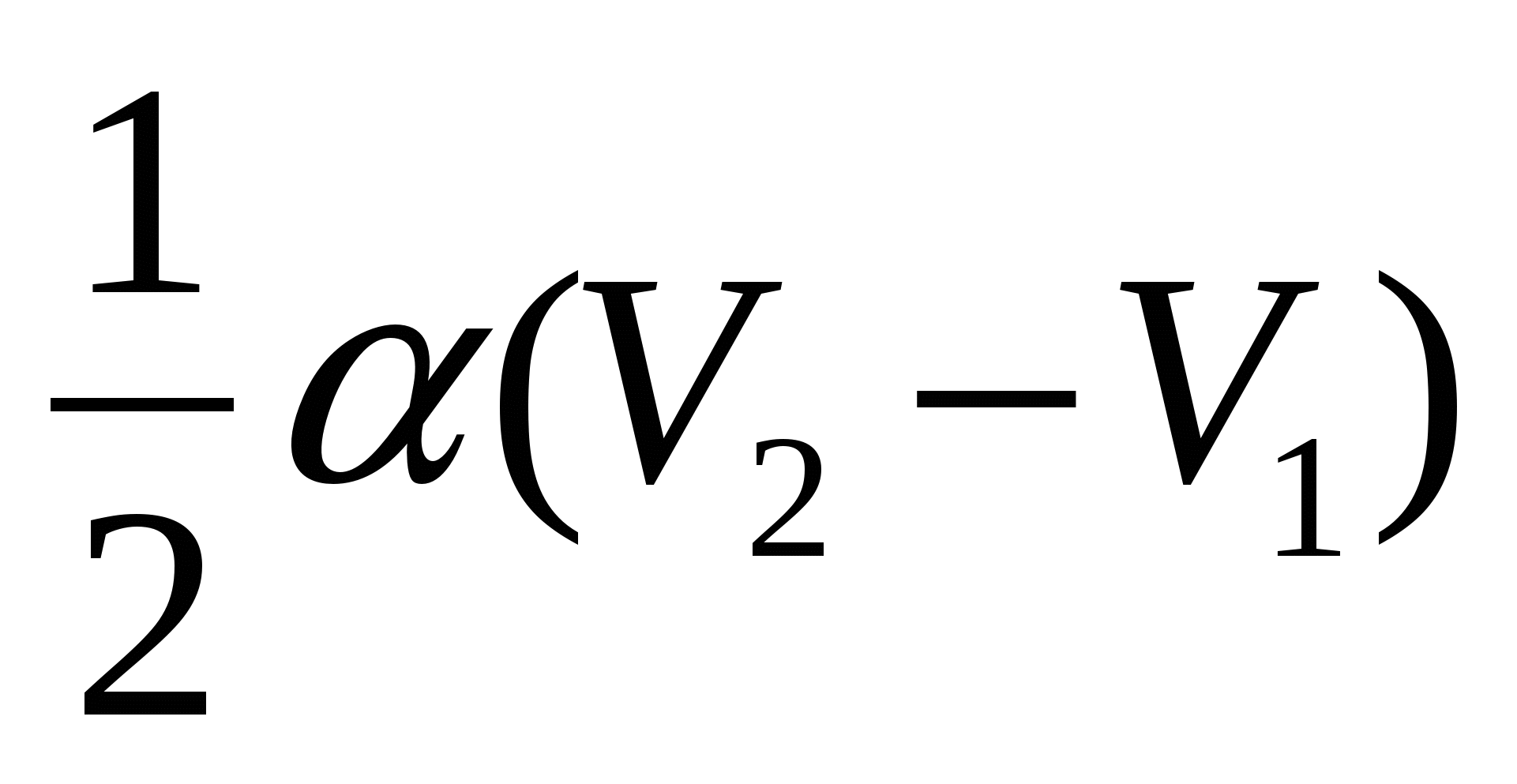 ; B.)
; B.) 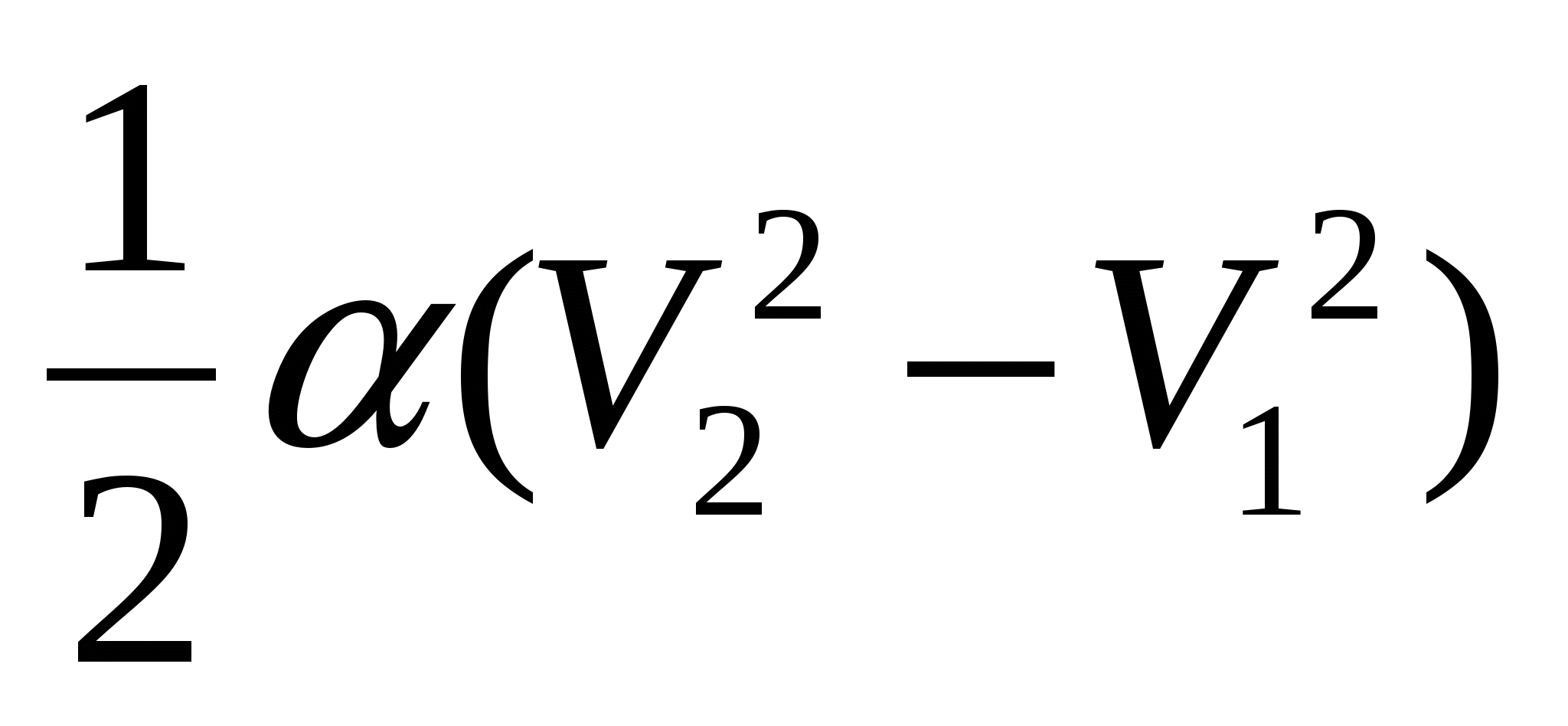 ; V.)
; V.)  .
.
2.29. 4 mol të një gazi monoatomik ideal janë të ngjeshur në një cilindër kompresori. Sa u rrit temperatura e gazit nëse puna është bërë 500 J? Procesi konsiderohet adiabatik.
A.) 80 K; B.) 10 K; C.) 50 K.
2.30. Gazi përfundon ciklin Carnot. 70% e nxehtësisë së marrë nga ngrohësi i kthehet frigoriferit. Temperatura e ngrohësit 430 K. Përcaktoni temperaturën e frigoriferit.
A.) 3 K; B.) 301 K; B.) 614 K.
Çelësat e përgjigjeve të sakta
| Niveli i kërkimit | Numrat e detyrave dhe përgjigjet e sakta |
|||||||||
| niveli 1 (1 pikë) | 2.01 | 2.02 | 2.03 | 2.04 | 2.05 | 2.06 | 2.07 | 2.08 | 2.09 | 2.10 |
| A | V | B | G | V | G | V | V | B | B |
|
| niveli i 2-të (2 pikë) | 2.11 | 2.12 | 2.13 | 2.14 | 2.15 | 2.16 | 2.17 | 2.18 | 2.19 | 2.20 |
| D | G | V | A | G | G | G | A | V | A |
|
| Niveli 3 (3 pikë) | 2.21 | 2.22 | 2.23 | 2.24 | 2.25 | 2.26 | 2.27 | 2.28 | 2.29 | 2.30 |
| A | V | A | G | B | A | A | B | B | B |
|
2.1.2 Gaz ideal. Presioni dhe temperatura e gazit. Shkalla e temperaturës
Përdorimi i teorisë kinetike molekulare model i idealizuarideale gaz, sipas të cilit:
1) vëllimi i brendshëm i molekulave të gazit është i papërfillshëm në krahasim me vëllimin e enës;
2) nuk ka forca ndërveprimi ndërmjet molekulave të gazit;
3) përplasjet e molekulave të gazit me njëra-tjetrën dhe me muret e enës janë absolutisht elastike. Modeli ideal i gazit mund të përdoret për të studiuar gazrat realë, pasi, në kushte normale, ato janë të ngjashme në vetitë e tyre me kërkesat e modelit ideal të gazit.
Në të vërtetë, duke bërë lëvizje të rastësishme, molekulat e gazit herë pas here i afrohen mureve të një ene ose sipërfaqes së trupave të tjerë në distanca mjaft të vogla. Në të njëjtën mënyrë, molekulat mund të afrohen mjaft me njëra-tjetrën dhe forcat e ndërveprimit lindin midis molekulave të gazit ose midis një molekule gazi dhe molekulave të substancës së murit, të cilat zvogëlohen shumë shpejt me distancën. Nën ndikimin e këtyre forcave, molekulat e gazit ndryshojnë drejtimin e lëvizjes. Ky proces (ndryshimi i drejtimit), siç e dini, quhet përplasje.
Përplasjet e molekulave me njëra-tjetrën luajnë një rol shumë të rëndësishëm në gjendjen e gazit. Dhe ne do t'i studiojmë ato në detaje më vonë. Tani është e rëndësishme të merren parasysh përplasjet e molekulave me muret e enës ose me çdo sipërfaqe tjetër në kontakt me gazin. Është ndërveprimi i molekulave të gazit dhe i mureve që përcakton forcën e përjetuar nga muret nga ana e gazit, e cila zakonisht karakterizohet presioniR, dmth me forcë F, për njësi sipërfaqe S sipërfaqja e murit normal me këtë mur:
|
fq = F/ S |
Vetia e një gazi për të ushtruar presion në muret e një ene që e përmban është një nga vetitë kryesore të një gazi. Është përmes presionit të tij që gazi më shpesh zbulon praninë e tij. Prandaj, vlera e presionit është një nga karakteristikat kryesore të gazit.
Supozoni se gazi është i mbyllur në një enë në formë paralelepipedi (Figura 2.4) dhe se gazi është në ekuilibër. Le të llogarisim presionin e gazit në një nga muret e anijes, për shembull, në murin anësor të djathtë një krevat. Le të drejtojmë boshtin koordinativ X përgjatë buzës së paralelipipedit pingul me murin një krevat, siç tregohet në figurën - 2.4). Pavarësisht se si drejtohen shpejtësitë v molekulat, do të na interesojnë vetëm projeksionet v x shpejtësitë molekulare për bosht X: drejt murit një krevat molekulat lëvizin saktësisht me shpejtësi v x .
|
Figura - 2.4 |
Le të zgjedhim mendërisht një shtresë gazi me një trashësi Dh, ngjitur me murin e zgjedhur. Një forcë elastike vepron mbi të nga ana e murit të deformuar F. Gazi vepron në mur me të njëjtën forcë në vlerë absolute. Sipas ligjit të dytë të Njutonit, impulsi i forcës F∆ t (ku ∆ t - një interval kohor arbitrar) është i barabartë me ndryshimin e momentit të gazit në shtresën tonë. Por gazi është në një gjendje ekuilibri, kështu që shtresa nuk ka rritje të momentit në drejtim të momentit të forcës (kundër drejtimit pozitiv të boshtit X) mos e mer. Kjo ndodh sepse, për shkak të lëvizjeve molekulare, shtresa e përzgjedhur merr një impuls në drejtim të kundërt dhe, natyrisht, të njëjtin në vlerë absolute. Nuk është e vështirë për ta llogaritur atë.
Në rastin e lëvizjeve të rastësishme të molekulave të gazit për një kohë ∆ t një numër i caktuar molekulash hyjnë në shtresën tonë nga e majta në të djathtë, dhe i njëjti numër molekulash e lënë atë brenda drejtim i kundërt- nga e djathta në të majtë. Molekulat hyrëse mbajnë me vete një moment të caktuar. Molekulat që largohen nga vëllimi i përzgjedhur mbajnë të njëjtin moment të shenjës së kundërt, kështu që momenti total i marrë nga shtresa është i barabartë me shumën algjebrike të momentit të molekulave që hyjnë dhe dalin nga shtresa. Le të gjejmë numrin e molekulave që hyjnë në shtresën tonë nga e majta gjatë kohës ∆ t.
Gjatë kësaj kohe deri në kufi a" b" c" d" në të majtë, ato molekula që janë prej saj në një distancë jo më të madhe v x ∆ t. Të gjithë ata janë në vëllimin e një paralelepipedi me një sipërfaqe bazë S(kjo është zona e murit të konsideruar) dhe gjatësia v x ∆ t, dmth në vëllim Sv x ∆ t. Nëse njësia e vëllimit të enës përmban NS molekulat, atëherë në vëllimin e treguar ka nSv x ∆ t molekulat. Por vetëm gjysma e tyre lëvizin nga e majta në të djathtë dhe bien në shtresë. Gjysma tjetër largohet prej saj dhe nuk futet në shtresë. Prandaj, gjatë kohës ∆ t në shtresë nga e majta në të djathtë hyn 1/2 nSv∆ t molekulat. Secila prej tyre ka një impuls mv x, dhe momenti total i futur prej tyre në shtresë është i barabartë me 1/2 nmv x 2 S ∆ t. Në të njëjtën kohë, shtresa largohet, duke lëvizur nga e djathta në të majtë. , i njëjti numër molekulash me të njëjtin vrull total, por me shenjë të kundërt. Kështu, për shkak të ardhjes së molekulave me një moment pozitiv në shtresë dhe largimit të molekulave me një moment negativ prej saj, ndryshimi total në momentin e shtresës është 1/2 nmv x 2 S ∆ t – (-1/2 nmv x 2 S ∆ t) = nmv x 2 S ∆ t. Është ky ndryshim në momentin e shtresës që kompenson ndryshimin që duhet të kishte ndodhur nën veprimin e impulsit të forcës. F Në. Prandaj, mund të shkruajmë: F ∆ t = nmv x 2 S ∆ t. Duke i ndarë të dy anët e kësaj barazie me S ∆ t, marrim: fq = F/ S = nmv x 2 . Deri më tani, ne kemi supozuar në heshtje se të gjitha molekulat e gazit kanë të njëjtën projeksion shpejtësie v x . Në realitet, natyrisht, nuk është kështu. Dhe shpejtësia e molekulave v, dhe projeksionet e tyre v x për aks X molekula të ndryshme, natyrisht, janë të ndryshme. Le të marrim parasysh ndryshimin në shpejtësitë e molekulave dhe projeksionet e tyre në boshtet koordinative duke zëvendësuar vlerën v x 2 , përfshirë në formulën e fundit, mesatarja e saj vlera ‹ v x 2 ›, kështu që ne do t'i japim formulës për presionin e gazit formën e mëposhtme: fq = nm‹ v x 2 ›. Për shpejtësinë v çdo molekulë mund të shkruhet: v 2 = v x 2 +- v 2 y + v z 2 :
|
‹ v x 2 › = ‹ v x 2 ›+‹ v 2 y ›+‹ v z 2 ›. |
Për shkak të çrregullimit të plotë të lëvizjeve molekulare, mund të supozohet se vlerat mesatare të katrorëve të projeksioneve të shpejtësisë në tre boshtet koordinative janë të barabarta me njëra-tjetrën, d.m.th. ‹ v x 2 ›= v 2 y ›=‹ v z 2 ›. Kjo do të thotë se < v x2 ›= v2/3. Duke e zëvendësuar këtë shprehje në formulën Le të llogarisim presionin e gazit në një nga muret e presionit që marrim: p = mv 2 /3 , ose, duke shumëzuar dhe pjesëtuar me dy anën e djathtë të kësaj barazie, gjejmë
|
p = 2/3nmv 2 /2 |
Arsyetimi i thjeshtë i mësipërm është i vlefshëm për çdo mur anijeje dhe për çdo zonë që mund të vendoset mendërisht në gaz. Në të gjitha rastet, marrim rezultatin për presionin e gazit, të shprehur me formulën e fundit. Madhësia mv 2 /2 përfaqëson energjinë kinetike mesatare të një molekule gazi. Prandaj, presioni i gazit është i barabartë me dy të tretat e energjisë mesatare kinetike të molekulave të përfshira në një njësi vëllimi të gazit. Ky është një nga përfundimet më të rëndësishme të teorisë kinetike të një gazi ideal. Ai vendos një lidhje midis sasive molekulare, domethënë sasive që i përkasin një molekule individuale, dhe karakteristikës makroskopike të një gazi - vlera e presionit që karakterizon gazin në tërësi - një sasi që matet drejtpërdrejt eksperimentalisht. Ekuacioni (2.9) quhen ekuacioni themelor i teorisë kinetike të gazeve ideale... Është e rëndësishme të theksohet se presioni i gazit përcaktohet nga mesatarja energjia kinetike e molekulave të saj. Kjo do të thotë se presioni i gazit është një sasi që lidhet me faktin se një gaz përbëhet nga një numër i madh molekulash.
Një nga parametrat e rëndësishëm termodinamikë që karakterizon gjendjen e një gazi është temperatura. Temperatura luan një rol të rëndësishëm jo vetëm në termodinamikë, por edhe në fizikë në përgjithësi. Nëse një trup ose një sistem trupash nuk është në gjendje ekuilibri termik dhe nëse sistemi është i izoluar (nuk ndërvepron me trupa të tjerë), atëherë pas një kohe gjendja e ekuilibrit termik vendoset vetvetiu. Gjendja e ekuilibrit termik është gjendja në të cilën kalon çdo sistem i izoluar.
Një nga shenjat e gjendjes së ekuilibrit termik është barazia e temperaturave të të gjitha pjesëve të trupit ose të gjithë trupave të sistemit. Dihet se në procesin e vendosjes së ekuilibrit termik, d.m.th. kur temperatura e dy trupave barazohet, nxehtësia transferohet nga një trup në tjetrin. Prandaj, nga pikëpamja eksperimentale, temperatura e një trupi është një sasi që përcakton nëse ai do të transferojë nxehtësi në një trup tjetër me një temperaturë të ndryshme ose do të marrë nxehtësi prej tij.
Ky eksperiment i thjeshtë tregon se temperatura është një sasi që karakterizon gjendjen e ekuilibrit termik: trupat në një gjendje ekuilibri termik kanë të njëjtat temperatura. Në të kundërt, trupat me të njëjtën temperaturë janë në ekuilibër termik me njëri-tjetrin. Dhe nëse dy trupa janë në ekuilibër termik me një trup të tretë, atëherë të dy trupat janë në ekuilibër termik me njëri-tjetrin. Kjo deklaratë e rëndësishme është një nga ligjet themelore të natyrës. Temperatura- një sasi fizike që karakterizon gjendjen e ekuilibrit termodinamik të një sistemi makroskopik.
Për matjen e temperaturës kanë kohë që përdorin faktin se kur ndryshon temperatura e trupit ndryshojnë edhe vetitë e tij. Rrjedhimisht, vlerat që karakterizojnë këto veti ndryshojnë. Prandaj, për të krijuar termometër, zgjidhni çdo substancë (substancë termometrike) dhe një vlerë të caktuar që karakterizon vetinë e një substance (vlera termometrike). Zgjedhja e të dyjave është krejtësisht arbitrare. Në termometrat shtëpiake, për shembull, substanca termometrike është merkuri, dhe vlera termometrike është gjatësia e kolonës së merkurit.
Në mënyrë që vlera e temperaturës të krahasohet me vlera të caktuara numerike, është gjithashtu e nevojshme të vendosni një ose një tjetër varësi të vlerës termometrike nga temperatura. Zgjedhja e kësaj varësie është gjithashtu arbitrare: për sa kohë që nuk ka termometër, është e pamundur të përcaktohet eksperimentalisht kjo varësi. Në rastin e një termometri merkuri, për shembull, zgjidhet një varësi lineare e gjatësisë së kolonës së merkurit (vëllimi i merkurit) nga temperatura.
Mbetet të vendoset njësia e temperaturës - një shkallë (megjithëse në parim mund të shprehet në të njëjtat njësi në të cilat matet vlera termometrike, për shembull, me një termometër merkuri - në centimetra). Madhësia e shkallës zgjidhet gjithashtu në mënyrë arbitrare (si substanca termometrike ashtu edhe forma e funksionit që lidh vlerën termometrike me temperaturën).
Madhësia e diplomës është vendosur si më poshtë. Zgjidhni, përsëri në mënyrë arbitrare, dy temperatura (ato quhen pika referimi) - zakonisht këto janë temperaturat e shkrirjes së akullit dhe ujit të vluar në presioni atmosferik- dhe ndajeni këtë interval të temperaturës në një numër të caktuar (gjithashtu arbitrar) pjesësh të barabarta - gradë, dhe njërës prej këtyre dy temperaturave i caktohet një vlerë e caktuar numerike. Kjo përcakton vlerën e temperaturës së dytë dhe çdo temperaturë të ndërmjetme. Kështu, njeriu merr shkalla e temperaturës.
Termometria moderne bazohet në shkallë ideale e gazit, instaluar me termometër gazi. Në parim, një termometër gazi është një enë e mbyllur e mbushur me një gaz ideal dhe e pajisur me një matës presioni për të matur presionin e gazit. Substanca termometrike në një termometër të tillë është një gaz ideal, dhe vlera termometrike është presioni i gazit në vëllim konstant. Temperatura matet në mënyrë indirekte nga ndryshimi i presionit të gazit në enë. 1 në vëllim konstant Kjo na lejon të supozojmë se raporti i presionit në pikat e vlimit të ujit ( R për të) dhe shkrirja e akullit (R 0 ) është e barabartë me raportin e vetë këtyre temperaturave: R për të / R 0 = T për të / T 0
Qëndrimi R për të / R 0 lehtë për t'u përcaktuar nga përvoja. Matjet e shumta kanë treguar se R për të / R 0 = 1,3661. Prandaj, ky është kuptimi i raportit të temperaturës: T për të /T 0 = 1,3661. Madhësia e shkallës zgjidhet duke ndarë diferencën T për të - T 0 për njëqind pjesë: T për të - T 0 =100.
Nga dy barazitë e fundit rezulton se temperatura e shkrirjes së akullit T 0 sipas shkallës që kemi zgjedhur është 273.15 gradë, dhe pika e vlimit të ujit T për të është e barabartë me 373.15 gradë. Për të matur temperaturën e një trupi me një termometër gazi, është e nevojshme të vini trupin në kontakt me një termometër gazi dhe, pasi të prisni ekuilibrin, të matni presionin. R gaz në termometër. Pastaj temperatura e trupit T përcaktohet nga formula
|
T = 273,15(p / fq 0 ) |
ku R 0 -- presioni i gazit në një termometër të vendosur në shkrirjen e akullit. Kështu që ju mund të merrni shkallën termometrike me metodën empirike - shkallë empirike e temperaturës. Në praktikë, një termometër gazi përdoret rrallë. Një rol më i përgjegjshëm i është caktuar - të gjithë termometrat e përdorur janë kalibruar sipas tij. Në këtë mënyrë, mund të merren termometra të ndryshëm dhe shkallë të temperaturës së panumërt.
Bërja e termometrave të mirë dhe matja e temperaturave, veçanërisht në një gamë të gjerë temperaturash, nuk janë detyra të lehta. Të matësh temperaturën e një trupi do të thotë ta krahasosh atë me temperaturën e një standardi. Është e natyrshme të zgjidhet një gaz ideal për standardin, pasi temperatura e një gazi të tillë përcaktohet lehtësisht përmes makroparametrave, si vëllimi ose presioni. Për më tepër, nëse njëra nga këto sasi është e fiksuar, atëherë tjetra për një masë të caktuar gazi ndryshon në mënyrë lineare me ndryshimin e temperaturës T. Në mënyrë që temperaturat e dy trupave, të hetuara dhe të referuara, të bëhen të barabarta, është e nevojshme që ato të vendosen në ekuilibër termik.
Termometrat e gazit zakonisht përdoren si instrumente parësore, të cilat përdoren për të kalibruar termometrat dytësorë të përdorur drejtpërdrejt në eksperimente. Termometrat dytësorë më të përdorur janë termometrat e lëngët, termometrat e rezistencës dhe termoelementet.
Termometrat më të thjeshtë janë termometrat e lëngshëm, ku trupi termometrik është merkuri ose alkool etilik. Një termometër merkuri është një rezervuar qelqi sferik ose cilindrik, në të cilin është ngjitur një kapilar i hollë i bërë nga qelqi i të njëjtit lloj. Temperatura lexohet në një shkallë të ngjitur në kapilar (Figura - 2.5). Në mënyrë tipike, termometrat e lëngshëm përdoren në intervalin e temperaturës nga 125 në 900 K. Kufiri i poshtëm i temperaturës së matur përcaktohet nga vetitë e lëngut, ai i sipërm - nga vetitë e xhamit kapilar.
Figura 2.6 tregon një termometër merkuri i përbërë nga një rezervuar i vogël merkuri që përfundon në një kapilar të hollë. Kur nxehet, merkuri zgjerohet dhe niveli i tij h në kapilar ngrihet. Shkalla dhe origjina e temperaturës mund të zgjidhen lirisht.
|
|
|
|
Figura - 2.5 |
Figura - 2.6 |
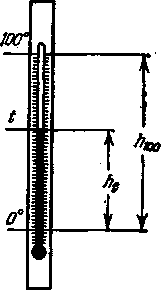
Shkalla më e zakonshme për matjen e temperaturës në praktikën ndërkombëtare është gradë Celsius. Në këtë rast, temperatura e shkrirjes së akullit në kushte normale, d.m.th., në presion R= 1 ATM, dhe për 100 ° - pika e vlimit të ujit (në të njëjtat kushte). Duke e ndarë pastaj lartësinë e kapilarit h 100 ndërmjet këtyre dy pikave në 100 pjesë të barabarta, mund të përcaktoni temperaturën t në gradë Celsius në raport me lartësinë e ngritjes së merkurit në kapilar h t në intervalin ndërmjet dy pikave konstante, d.m.th.
Një përcaktim i tillë i temperaturës është i përshtatshëm vetëm për matje të përafërta në jetën e përditshme. Me matje më të sakta. është konstatuar se për lëngje të ndryshme termometrike, për shembull, për termometra me merkur dhe alkool, në të njëjtën temperaturë, vlerat numerike të raporteve h 1 / h 100 - përkojnë me njëra-tjetrën vetëm për pikat konstante të zgjedhura. Në temperaturat e ndërmjetme, leximet e të dy termometrave do të ndryshojnë pak, pasi ligjet e zgjerimit të lëngjeve të ndryshme dhe enëve që përmbajnë ato janë të ndryshme.
Në teknologjinë moderne, më të përshtatshmet janë metodat elektrike për matjen e temperaturës. Në të ashtuquajturat termometra rezistence përdoret për të ndryshuar rezistencën e metaleve dhe gjysmëpërçuesve kur ato nxehen. Termoelementet ose termoçiftet matet forca elektromotore që ndodh kur pika e kontaktit të dy metaleve ose gjysmëpërçuesve nxehet.
Në termometrat e rezistencës, trupi termometrik është një metal ose gjysmëpërçues, rezistenca e të cilit ndryshon me temperaturën. Ndryshimi i rezistencës me temperaturën matet duke përdorur qarqet e urës (Figura - 2.7). Termometrat e rezistencës nga metalet përdoren në intervalin e temperaturës nga 70 në 1300 K, nga gjysmëpërçuesit (termistorët) - në rangun nga 150 në 400 K, dhe termometrat e karbonit - deri në temperaturat e heliumit të lëngshëm.
Me çdo metodë të përcaktimit të temperaturës në shkallën e temperaturës, mund të shënoni një pikë që ka një vlerë absolute. Kjo pikë korrespondon me temperaturën në të cilën nuk ka lëvizje kaotike (termike) të molekulave dhe quhet temperatura zero absolute (T= 0 ° C = 0 ° K). Në rastin e një gazi ideal, vlera T= 0 korrespondon me mungesën e energjisë kinetike të lëvizjes përkthimore të molekulave dhe mungesës së presionit. Një shkallë e tillë për matjen e temperaturës quhet një shkallë absolute, njësia e matjes është shkalla Kelvin ( TE). Nuk duhet menduar se në temperaturën zero absolute të gjitha lëvizjet e grimcave të materies pushojnë. Edhe nëse të gjitha molekulat e gazit ndalojnë, atëherë brenda tyre elektronet do të lëvizin në orbita të caktuara rreth bërthamave, në një mënyrë të caktuar protonet dhe neutronet do të marrin pjesë në lëvizjen brenda bërthamave. Më poshtë do të sigurohemi që, për shembull, energjia kinetike mesatare e elektroneve të lira në një metal në zero absolute të jetë qindra herë më e lartë se energjia mesatare kinetike e molekulave të gazit në temperaturën e dhomës, etj.