Fakti që të gjitha izobaret konvergojnë në një pikë (Fig. 1.9) nuk është një aksident, por një rregullsi që ka një kuptim fizik. Ligji i Gay Lussac nuk e mohon mundësinë e një rritjeje të pakufizuar të temperaturës, sepse vëllimi i gazit me një rritje të temperaturës mund të rritet pafundësisht. Sidoqoftë, me një rënie të temperaturës, ajo tenton në zero dhe ka një kufi ( V = 0), pasi nuk mund të jetë negativ.
Në fakt, gazrat e vërtetë as nuk mund ta arrijnë këtë kufi, pasi atomet dhe molekulat e tyre, edhe pse të vogla në madhësi, ende kanë një vëllim të caktuar.
Nëse në ekuacion (V -V 0) /V 0 =αΔ t, sugjeroj që V 0 - ky është vëllimi i gazit në t 0= 0 ° C, pra Δ t =t -t 0 =t, dhe e barazojmë atë me zero si kufiri i poshtëm i vëllimit, atëherë marrim vlerën e temperaturës më të ulët në shkallën Celsius që trupat mund të kenë:
0 = V 0. (1 + t / 273).
1 + t / 273 = 0, t = -273° C
Pra, temperatura mund të rritet pafundësisht, por në natyrë ekziston një kufi më i ulët - zero absolute, poshtë së cilës nuk mund të zbresë. Kjo është arsyeja pse izobaret e të gjitha gazrave konvergojnë në një pikë në boshtin e temperaturës, që është -273 ° C.
Jo gjithçka në botë është relative; ka edhe vlera absolute, në veçanti zero absolute temperatura.
Ekzistenca zero absolute temperaturë u vendos nga shkencëtari anglez W. Thomson ( Kelvin) në bazë të ndërtimit shkallë absolute e temperaturës, e cila nuk varet nga vetitë e trupit metrik dhe për këtë arsye mund të konsiderohet ideale. Material nga siti

William Thomson (Lord Kelvin) (1824 - 1907). Fizikanti anglez, një nga themeluesit e termodinamikës dhe teorisë kinetike molekulare, teoria e fenomeneve termoelektrike, themelet e lëkundjeve elektromagnetike. Ai formuloi ligjin e dytë të termodinamikës, prezantoi shkallën absolute të temperaturës (shkalla Kelvin), zbuloi efektin termodinamik, nxori formulën për periudhën e lëkundjeve natyrore elektromagnetike në qarkun oshilator, bëri llogaritjet e madhësisë së molekulave, etj. arritjet shkencore mori titullin Lord Kelvin.
Pika fillestare e shkallës është zero absolute temperaturë, vlera e saktë e së cilës është -273.15 ° C. Njësia e matjes është vlera që quhet në SI kelvin(TO); është e barabartë në madhësi në një shkallë Celsius(° C): 1 K = 1 ° C. Prandaj, midis temperaturës absolute T dhe temperatura në shkallën Celsius t ekziston një marrëdhënie e thjeshtë (Fig. 1.10):
T =t + 273.
Koncept temperatura absolute përdoret gjerësisht në termodinamikë dhe fizikë molekulare, pasi ka një kuptim të thellë fizik dhe thjeshton shkrimin e shumë ekuacioneve.
Në këtë faqe material mbi temat:
Shkallë termodinamike e temperaturës zero absolute abstrakte
Leksion shkallë e temperaturës absolute
Fenomenet termoelektrike dhe fizika molekulare
-
Temperatura është një masë sasiore e "ngrohtësisë" së trupit. Koncepti i temperaturës zë një vend të veçantë në seri sasitë fizike përcaktimi i gjendjes së sistemit. Temperatura jo vetëm që karakterizon gjendjen e ekuilibrit termik të një trupi të caktuar. Alsoshtë gjithashtu parametri që merr të njëjtën vlerë për çdo dy ose më shumë trupa në ekuilibër termik me njëri -tjetrin, d.m.th. karakterizon ekuilibrin termik të një sistemi trupash. Kjo do të thotë që nëse dy ose më shumë trupa me temperatura të ndryshme vihen në kontakt, atëherë si rezultat i ndërveprimit midis molekulave, këto trupa do të marrin të njëjtën vlerë të temperaturës.
Teoria kinetike molekulare bën të mundur sqarimin e kuptimit fizik të temperaturës. Duke krahasuar shprehjet (2.4) dhe (2.7), shohim se ato përkojnë nëse i vendosim
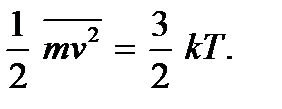 (2.9)
(2.9)Këto marrëdhënie quhen ekuacionet e dyta themelore të teorisë kinetike molekulare të gazrave. Ata e tregojnë atë temperatura absolute ekziston një sasi që përcakton energjinë mesatare kinetike të lëvizjes përkthimore të molekulave; është një masë e energjisë së lëvizjes përkthimore të molekulave, dhe kështu intensitetit të lëvizjes termike të molekulave. Ky është kuptimi molekular-kinetik i temperaturës absolute. Siç mund ta shihni, procesi i ngrohjes së një trupi lidhet drejtpërdrejt me një rritje të energjisë mesatare kinetike të grimcave të trupit. Nga (2.9) mund të shihet se temperatura absolute është një vlerë pozitive:
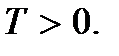 Kuptim
Kuptim 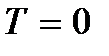 quhet zero zero absolute. Sipas (2.8), në zero absolute, lëvizja përkthimore e grimcave (
quhet zero zero absolute. Sipas (2.8), në zero absolute, lëvizja përkthimore e grimcave ( 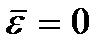 ) Sidoqoftë, duhet të theksohet se në temperatura të ulëta gazi shndërrohet në një gjendje të kondensuar. Rrjedhimisht, të gjitha përfundimet e nxjerra në bazë të teorisë kinetike të gazeve gjithashtu humbin kuptimin e tyre. Dhe në temperaturën absolute zero, lëvizja nuk zhduket. Lëvizja e elektroneve në atome, lëvizja e elektroneve të lira në metale ruhen plotësisht edhe në një temperaturë zero zero. Përveç kësaj, edhe në zero absolute, disa lëvizje vibruese të atomeve brenda molekulave dhe atomeve në nyjet e grilës kristalore ruhen. Ekzistenca e këtyre lëkundjeve shoqërohet me praninë e energjisë zero në oshilatorin kuantik harmonik (
) Sidoqoftë, duhet të theksohet se në temperatura të ulëta gazi shndërrohet në një gjendje të kondensuar. Rrjedhimisht, të gjitha përfundimet e nxjerra në bazë të teorisë kinetike të gazeve gjithashtu humbin kuptimin e tyre. Dhe në temperaturën absolute zero, lëvizja nuk zhduket. Lëvizja e elektroneve në atome, lëvizja e elektroneve të lira në metale ruhen plotësisht edhe në një temperaturë zero zero. Përveç kësaj, edhe në zero absolute, disa lëvizje vibruese të atomeve brenda molekulave dhe atomeve në nyjet e grilës kristalore ruhen. Ekzistenca e këtyre lëkundjeve shoqërohet me praninë e energjisë zero në oshilatorin kuantik harmonik ( 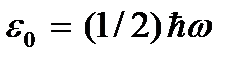 ), të cilat mund të konsiderohen dridhjet e lartpërmendura të atomeve. Kjo energji nuk varet nga temperatura, që do të thotë se nuk zhduket as në
), të cilat mund të konsiderohen dridhjet e lartpërmendura të atomeve. Kjo energji nuk varet nga temperatura, që do të thotë se nuk zhduket as në 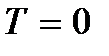 ... Në temperatura të ulëta, konceptet klasike të lëvizjes pushojnë së përmbushuri. Në këtë zonë, veprojnë ligjet kuantike, sipas të cilave lëvizja e grimcave nuk ndalet, edhe nëse temperatura e trupit ulet në zero absolute. Por shpejtësia e kësaj lëvizjeje nuk varet më nga temperatura dhe kjo lëvizje nuk është termike. Kjo konfirmohet nga parimi i pasigurisë. Nëse grimcat e trupit ishin në qetësi, atëherë pozicionet e tyre (koordinatat x, y, z) dhe impulset (projeksionet e impulsit p x, p y, p z) do të përcaktohej saktësisht
... Në temperatura të ulëta, konceptet klasike të lëvizjes pushojnë së përmbushuri. Në këtë zonë, veprojnë ligjet kuantike, sipas të cilave lëvizja e grimcave nuk ndalet, edhe nëse temperatura e trupit ulet në zero absolute. Por shpejtësia e kësaj lëvizjeje nuk varet më nga temperatura dhe kjo lëvizje nuk është termike. Kjo konfirmohet nga parimi i pasigurisë. Nëse grimcat e trupit ishin në qetësi, atëherë pozicionet e tyre (koordinatat x, y, z) dhe impulset (projeksionet e impulsit p x, p y, p z) do të përcaktohej saktësisht 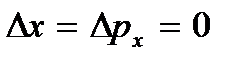 etj., dhe kjo bie ndesh me marrëdhëniet e pasigurisë
etj., dhe kjo bie ndesh me marrëdhëniet e pasigurisë 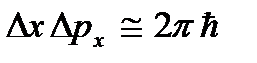 etj Zero absolute nuk është e arritshme. Më poshtë do të tregohet se temperatura zero absolute nënkupton një gjendje të sistemit në të cilin sistemi është në një gjendje me energjinë më të ulët, dhe për këtë arsye një rënie të mëtejshme të intensitetit të lëvizjes së grimcave të tij për shkak të transferimit të energjisë së tij në rrethinë trupat nuk është e mundur.
etj Zero absolute nuk është e arritshme. Më poshtë do të tregohet se temperatura zero absolute nënkupton një gjendje të sistemit në të cilin sistemi është në një gjendje me energjinë më të ulët, dhe për këtë arsye një rënie të mëtejshme të intensitetit të lëvizjes së grimcave të tij për shkak të transferimit të energjisë së tij në rrethinë trupat nuk është e mundur.Formula (2.7) mund të shkruhet si.
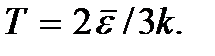
Kjo formulë mund të shërbejë si një përkufizim i konceptit të temperaturës absolute për një gaz monatomik. Temperatura e çdo sistemi tjetër mund të përcaktohet si një vlerë e barabartë me temperaturën e një gazi monatomik në ekuilibrin termik me këtë sistem. Përcaktimi i temperaturës duke përdorur këtë formulë është i saktë deri në temperaturat në të cilat probabiliteti i shfaqjes së gjendjeve të ngacmuara elektronikisht të atomeve të gazit nuk mund të neglizhohet më.
Lidhja (2.8) na lejon të prezantojmë të ashtuquajturën shpejtësi mesatare katrore të një molekule, duke e përcaktuar atë si
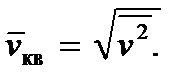
Pastaj marrim
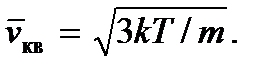
Koncepti i temperaturës absolute mund të futet në mënyrë më rigoroze në fizikën statistikore, ku mund të konsiderohet si moduli i shpërndarjes statistikore të energjisë të grimcave. Ne gjithashtu vërejmë se meqenëse temperatura, si dhe presioni, siç mund të shihet nga formula (2.7) dhe (2.8), përcaktohet nga energjia mesatare kinetike e një molekule gazi ideal, atëherë toni janë sasi statistikore dhe, prandaj , nuk ka kuptim të flasim për temperaturën ose presionin e një ose një numri të vogël të molekulave.
Zgjedhja e pikave të shkrirjes së akullit dhe ujit të vlimit si pikat kryesore të shkallës së temperaturës është plotësisht arbitrare. Marrë kështu shkalla e temperaturës doli të ishte e papërshtatshme për kërkime teorike.
Bazuar në ligjet e termodinamikës, Kelvin arriti të ndërtojë të ashtuquajturën shkallë të temperaturës absolute (tani quhet shkalla e temperaturës termodinamike ose shkalla Kelvin), plotësisht e pavarur nga natyra e trupit termometrik ose parametri termometrik i zgjedhur. Sidoqoftë, parimi i ndërtimit të një shkalle të tillë shkon përtej kurrikulës shkollore. Ne do ta shikojmë këtë pyetje duke përdorur konsiderata të tjera.
Nga formula (2), pasojnë dy mënyra të mundshme për përcaktimin e shkallës së temperaturës: përdorimi i një ndryshimi në presionin e një sasie të caktuar të gazit në një vëllim konstant ose një ndryshim në vëllimin në presion konstant... Kjo shkallë quhet shkallë ideale e temperaturës së gazit.
Temperatura e përcaktuar me barazinë (2) quhet temperatura absolute... Temperatura absolute? nuk mund të jetë negative, pasi në të majtë në barazi (2) ka vlera të dukshme pozitive (më saktësisht, nuk mund të ketë shenja të ndryshme, mund të jetë pozitive ose negative. Kjo varet nga zgjedhja e shenjës së konstantes k . Meqenëse temperatura e pikës së trefishtë është rënë dakord konsiderohet pozitive, atëherë temperatura absolute mund të jetë vetëm pozitive). Prandaj, vlera më e vogël e mundshme e temperaturës T = 0 është temperatura kur presioni ose vëllimi është zero.
Temperatura kufizuese në të cilën presioni i një gazi ideal zhduket në një vëllim fiks ose vëllimi i një gazi ideal tenton në zero (domethënë, gazi, siç të thuash, duhet të ngjeshet në një "pikë") në një presion konstant , quhet zero absolute... Kjo është më së shumti temperaturë të ulët në natyrë.
Nga barazia (3), duke marrë parasysh që
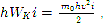
vijon kuptimi fizik i zeros absolute: zero absolute është temperatura në të cilën lëvizja termale e përkthimit të molekulave duhet të ndalet. Zero absolute është e paarritshme.
Sistemi Ndërkombëtar i Njësive (SI) përdor një shkallë të temperaturës absolute termodinamike. Zeroja absolute merret si temperaturë zero në këtë shkallë. Pika e dytë referuese është temperatura në të cilën uji, akulli dhe avulli i ngopur janë në ekuilibër dinamik, e ashtuquajtura pikë e trefishtë (në shkallën Celsius, temperatura e pikës së trefishtë është 0.01 ° C). Çdo njësi e temperaturës absolute, e quajtur Kelvin (e shënuar me 1 K), është e barabartë me një gradë Celsius.
= .Çdo matje merr një pikë referimi. Temperatura nuk bën përjashtim. Për shkallën Fahrenheit, kjo pikë zero është temperatura e borës e përzier me kripë tryeze, për shkallën Celsius, pika e ngrirjes së ujit. Por ekziston një pikë referimi e veçantë për temperaturën - zero absolute.
Temperatura absolute zero korrespondon me 273.15 gradë Celsius nën zero, 459.67 gradë nën zero Fahrenheit. Për shkallën e temperaturës Kelvin, kjo temperaturë është në vetvete një pikë zero.
Thelbi i temperaturës zero absolute
Koncepti i zeros absolute vjen nga vetë thelbi i temperaturës. Çdo trup ka energji që i jep mjedisit të jashtëm gjatë transferimit të nxehtësisë. Në të njëjtën kohë, temperatura e trupit zvogëlohet, d.m.th. më pak energji mbetet. Teorikisht, ky proces mund të vazhdojë derisa sasia e energjisë të arrijë një minimum të tillë, në të cilin trupi nuk mund ta japë më atë.
Një paralajmërim i largët i një ideje të tillë mund të gjendet tashmë në M.V. Lomonosov. Shkencëtari i madh rus e shpjegoi ngrohtësinë me lëvizjen "rrotulluese". Rrjedhimisht, shkalla kufizuese e ftohjes është një ndalesë e plotë e një lëvizjeje të tillë.Sipas koncepteve moderne, temperatura absolute zero është një gjendje e materies në të cilën molekulat kanë nivelin më të ulët të mundshëm të energjisë. Me më pak energji, d.m.th. në një temperaturë më të ulët, asnjë trup fizik nuk mund të ekzistojë.
Teoria dhe praktika
Temperatura absolute zero është një koncept teorik, është e pamundur të arrihet në praktikë në parim, edhe në laboratorët shkencorë me pajisjet më të sofistikuara. Por shkencëtarët arrijnë të ftojnë materien në temperatura shumë të ulëta, të cilat janë afër zeros absolute.
Në temperatura të tilla, substancat fitojnë veti të mahnitshme që nuk mund t'i kenë në rrethana normale. Mërkuri, i cili quhet "argjend i gjallë" për shkak të gjendjes së tij të lëngët, bëhet i ngurtë në këtë temperaturë - deri në pikën ku mund të ngul gozhdë. Disa metale bëhen të brishtë si qelqi. Goma bëhet po aq e fortë dhe e brishtë. Nëse godisni një objekt gome me një çekiç në një temperaturë afër zeros absolute, ai do të thyhet si xhami.
Ky ndryshim në vetitë shoqërohet gjithashtu me natyrën e nxehtësisë. Sa më e lartë të jetë temperatura e trupit fizik, aq më intensive dhe kaotike lëvizin molekulat. Ndërsa temperatura zvogëlohet, lëvizja bëhet më pak intensive dhe struktura bëhet më e rregulluar. Pra gazi bëhet një lëng, dhe lëngu bëhet një i ngurtë. Niveli kufizues i renditjes është struktura kristalore. Në temperatura jashtëzakonisht të ulëta, ajo fitohet edhe nga substanca të tilla që në gjendjen e zakonshme mbeten amorfe, për shembull, gome.
Fenomene interesante ndodhin edhe me metalet. Atomet e grilës kristal vibrojnë me më pak amplituda, shpërndarja e elektroneve zvogëlohet, kështu që rezistenca elektrike bie. Metali fiton superpërcjellshmëri, zbatimi praktik i të cilit duket të jetë shumë joshës, edhe pse i vështirë për t’u arritur.
Temperatura kufizuese në të cilën vëllimi i një gazi ideal bëhet zero merret si temperaturë zero absolute. Sidoqoftë, vëllimi i gazrave realë në temperaturë absolute zero nuk mund të zhduket. A ka kuptim atëherë ky kufi i temperaturës?
Temperatura kufizuese, ekzistenca e së cilës rrjedh nga ligji Gay-Lussac, ka kuptim, pasi në praktikë është e mundur të afrohen vetitë e një gazi real me vetitë e një gazi ideal. Për ta bërë këtë, është e nevojshme të merret një gaz gjithnjë e më i rrallë në mënyrë që dendësia e tij të priret në zero. Në një gaz të tillë, me të vërtetë, vëllimi me uljen e temperaturës do të priret në atë kufizues, afër zeros.
Gjeni vlerën zero absolute në shkallën Celsius. Barazimi i vëllimit Vv formula (3.6.4) në zero dhe duke marrë parasysh atë
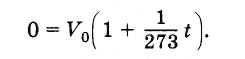
Prandaj, zero absolute e temperaturës është
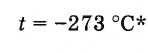
* Vlera më e saktë e zeros absolute: -273.15 ° С.
Kjo është ekstreme, temperatura më e ulët në natyrë, ajo "shkalla më e lartë ose e fundit e të ftohtit", ekzistenca e së cilës parashikoi Lomonosov.
Shkalla Kelvin

Kelvin William (Thomson W.) (1824-1907) - një fizikan i shquar anglez, një nga themeluesit e termodinamikës dhe teorisë kinetike molekulare të gazrave.
Kelvin prezantoi shkallën absolute të temperaturës dhe dha një nga formulimet e ligjit të dytë të termodinamikës në formën e pamundësisë së shndërrimit të plotë të nxehtësisë në punë. Ai llogariti madhësinë e molekulave bazuar në matjen e energjisë sipërfaqësore të lëngut. Në lidhje me vendosjen e kabllit telegrafik transatlantik, Kelvin zhvilloi teorinë e lëkundjeve elektromagnetike dhe nxori një formulë për periudhën e lëkundjeve të lira në qark. Për meritat shkencore W. Thomson mori titullin Lord Kelvin.
Shkencëtari anglez W. Kelvin prezantoi një shkallë absolute të temperaturës. Zero temperatura në shkallën Kelvin korrespondon me zero absolute, dhe njësia e temperaturës në këtë shkallë është e barabartë me gradë Celsius, pra temperatura absolute T lidhet me temperaturën në shkallën Celsius me formulën
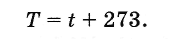 (3.7.6)
(3.7.6)Figura 3.11 tregon shkallën absolute dhe shkallën Celsius për krahasim.
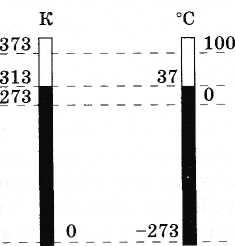
Njësia e temperaturës absolute në SI quhet kelvin (shkurtuar K). Prandaj, një shkallë në shkallën Celsius është e barabartë me një shkallë në shkallën Kelvin: 1 ° C = 1 K.
Kështu, temperatura absolute, sipas përcaktimit të dhënë me formulën (3.7.6), është një vlerë derivative që varet nga temperatura e Celsius dhe nga vlera e përcaktuar eksperimentalisht e a. Sidoqoftë, është me rëndësi themelore.
Nga pikëpamja e teorisë kinetike molekulare, temperatura absolute lidhet me energjinë mesatare kinetike të lëvizjes kaotike të atomeve ose molekulave. Në T =О К lëvizja termike e molekulave ndalet. Kjo diskutohet në mënyrë më të detajuar në Kapitullin 4.
Vëllimi kundrejt temperaturës absolute
Duke përdorur shkallën Kelvin, ligji i Gay-Lussac (3.6.4) mund të shkruhet në një formë më të thjeshtë. Sepse
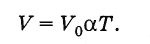 (3.7.7)
(3.7.7)Vëllimi i një gazi të një mase të caktuar në presion konstant është drejtpërdrejt proporcional me temperaturën absolute.
Nga kjo rrjedh se raporti i vëllimeve të gazit me të njëjtën masë në gjendje të ndryshme në të njëjtin presion është i barabartë me raportin e temperaturave absolute:
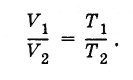 (3.7.8)
(3.7.8)Ekziston një temperaturë minimale e mundshme në të cilën vëllimi (dhe presioni) i një gazi ideal zhduket. Kjo është temperatura zero zero:-273 ° C. Convenientshtë i përshtatshëm për të lexuar temperaturën nga zero absolute. Kështu është ndërtuar shkalla e temperaturës absolute.