« Фізика – 10 клас»
Стан якого газу визначає рівняння Менделєєва-Клапейрона.
Чи можна універсальну постійну газову вважати фундаментальною постійною?
За допомогою рівняння стану ідеального газу можна досліджувати процеси, в яких маса газу та один із трьох параметрів – тиск, об'єм чи температура – залишаються незмінними.
Кількісні залежності між двома параметрами газу при фіксованому значенні третього називають газовими законами.
Процеси, що протікають при незмінному значенні одного з параметрів, називають ізопроцесами.
Слово «ізопроцес» – складне слово, перша частина якого походить від грецького слова isos – рівний, однаковий.
Зазначимо, що насправді жоден процес неспроможна протікати при суворо фіксованому значенні будь-якого параметра. Завжди є ті чи інші впливи, що порушують сталість температури, тиску чи об'єму. Лише в лабораторних умовах вдається підтримувати сталість того чи іншого параметра з високою точністю, але в технічних пристроях, що діють, і в природі це практично нездійсненно. Ізопроцес - це ідеалізована модель реального процесу, яка лише приблизно відображає дійсність.
Ізотермічний процес.
Процес зміни стану системи макроскопічних тіл (термодинамічної системи) за постійної температури називають ізотермічним.
Слово «ізотермічний» походить від грецьких слів isos – рівний, однаковий і therme – теплота.
Для підтримки температури постійної газу необхідно, щоб він міг обмінюватися теплом з великою системою - термостатом. Інакше при стисканні або розширенні температура газу змінюватиметься. Термостатом може бути атмосферне повітря, якщо температура його помітно не змінюється протягом усього процесу. Відповідно до рівняння стану ідеального газу (10.4), якщо маса газу не змінюється, у будь-якому стані з незмінною температурою тиск тиску газу на його обсяг залишається постійним:
pV=const при Т=const. (10.6)
Цей висновок був зроблений англійським вченим Р. Бойлем (1627-1691) і пізніше французьким ученим Еге. Маріоттом (1620-1684) з урахуванням експерименту. Тому він має назву закону Бойля-Mapuoттa.
Для газу даної маси добуток тиску газу на його обсяг постійно.
Закон Бойля-Маріотта справедливий зазвичай для будь-яких газів, а також їх сумішей, наприклад для повітря. Лише при тисках, у кілька сотень разів більших атмосферного, відхилення від цього закону стають суттєвими.
Криву, що зображує залежність тиску газу від об'єму за постійної температури, називають ізотермою.
Ізотерма газу зображує обернено пропорційну залежність між тиском і об'ємом. Криву такого роду в математиці називають гіперболою(Рис. 10.1).
Різним постійним температурам відповідають різні ізотерми. У разі підвищення температури газу тиск відповідно до рівняння стану (10.4) збільшується, якщо V = const. Тому ізотерма, що відповідає вищій температурі Т 2 лежить вище ізотерми, що відповідає більш низькій температурі Т 1 (див. рис. 10.1).
Для того, щоб процес відбувався при постійній температурі, стиснення або розширення газу має відбуватися дуже повільно. Справа в тому, що, наприклад, при стисканні газ нагрівається, так як при русі поршня в посудині швидкість і відповідно кінетична енергія молекул після ударів про поршень збільшуються, а отже, збільшується температура газу. Саме тому для реалізації ізотермічного процесу треба після невеликого усунення поршня почекати, коли температура газу в посудині знову стане рівною температурі навколишнього повітря.
Крім цього, зазначимо, що при швидкому стисканні тиск під поршнем відразу стає більшим, ніж у всій посудині. Якщо значення тиску і температури в різних точках об'єму різні, то в цьому випадку газ знаходиться в нерівноважному стані і ми не можемо назвати значення температури та тиску, що визначають даний моментстан системи. Якщо систему надати самій собі, то температура і тиск поступово вирівнюються, система входить у рівноважний стан.
Рівноважний стан- це стан, у якому температура і тиск у всіх точках обсягу однакові.
Параметри стану газу можуть бути визначені, якщо він у рівноважному стані.
Процес, при якому всі проміжні стани газу є рівноважними, називають рівноважним процесом.
Вочевидь, що у графіках залежності одного параметра від іншого ми можемо зображати лише рівноважні процеси.
Ізобарний процес
Процес зміни стану термодинамічної системи за постійного тиску називають ізобарним.
Слово «ізобарний» походить від грецьких слів isos – рівний, однаковий і baros – вага, тяжкість.
Відповідно до рівняння (10.4) у будь-якому стані газу з незмінним тиском відношення обсягу газу до його температури залишається постійним:
Цей закон був встановлений експериментально в 1802 р. французьким вченим Ж. Гей-Люссаком (1778-1850) і носить назву закону Гей-Люссака.
Закону Гей-Люссака:
Для газу даної маси при постійному тиску відношення обсягу абсолютної температури постійно.
Відповідно до рівняння (10.7) обсяг газу при постійному тиску пропорційний температурі:
V = const Т. (10.8)
Пряму, що зображує залежність об'єму газу від температури при постійному тиску, називають ізобарою.
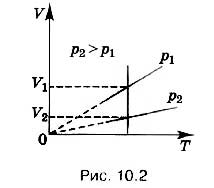
Різним тискам відповідають різні ізобари (рис. 10.2). Проведемо малюнку довільну ізотерму. Зі зростанням тиску обсяг газу за постійної температури відповідно до закону Бойля-Маріотта зменшується. Тому ізобара, що відповідає вищому тиску р 2 лежить нижче ізобари, що відповідає нижчому тиску p 1 .
В області низьких температурвсі ізобары ідеальногогазу сходяться в точці Т = 0. Але це не означає, що обсяг реальногогазу перетворюється на нуль. Всі гази при сильному охолодженні перетворюються на рідини, а до рідин рівняння стану (10.4) не застосовується. Саме тому, починаючи з деякого значення температури, залежність об'єму температури проводиться на графіку штриховою лінією. Насправді таких значень температури та тиску речовини в газоподібному стані бути не може.
Ізохорний процес
Процес зміни стану термодинамічної системи при постійному обсязі називають ізохорним.
Слово «ізохорний» походить від грецьких слів isos – рівний, однаковий і chora – місце, простір, займане чимось.
З рівняння стану (10.4) випливає, що у будь-якому стані газу з незмінним обсягом відношення тиску газу до його температури залишається постійним:
Цей газовий закон був встановлений у 1787 р. французьким фізиком Ж. Шарлем (1746-1823) і носить назву закону Шарля.
Для газу даної маси відношення тиску до абсолютної температури постійно, якщо об'єм не змінюється.
Відповідно до рівняння (10.9) тиск газу при постійному обсязі пропорційно температурі:
р = const Т. (10.10)
Пряму, що зображує залежність тиску газу від температури при постійному обсязі, називають ізохорою.
Різним обсягам відповідають різні ізохори. Також проведемо малюнку довільну ізотерму (рис. 10.3). Зі зростанням обсягу газу за постійної температури тиск його, згідно із законом Бойля-Маріотта, падає. Тому ізохора, що відповідає більшому об'єму V 2 лежить нижче ізохори, що відповідає меншому об'єму V 1 .
Відповідно до рівняння (10.10) всі ізохори ідеального газу починаються в точці Т = 0. Значить, тиск ідеального газу при абсолютному нуліодно нулю.
Збільшення тиску газу в будь-якій посудині або електричній лампочці при нагріванні можна вважати ізохорним процесом. Ізохорний процес використовується в газових термометрах постійного об'єму.
На закінчення складемо опорну схему (рис. 10.4) і покажемо логічні переходи, що пов'язують різні закони та рівняння.
2. Основи термодинаміки
2.01. При постійному тиску обсяг газу збільшиться на ∆V. Яка фізична величина дорівнює добутку р|∆V| в цьому випадку?
А.) робота, що здійснюється газом;
Б.) робота, що здійснюється над газом зовнішніми силами;
В.) кількість теплоти, одержану газом;
Г) внутрішня енергія газу.
2.02. Над тілом виконано роботу А зовнішніми силами, і тілу передано кількість теплоти Q. Чому дорівнює зміна внутрішньої енергії ∆U тіла?
А.) ∆U=А; Б.) ∆U=Q В.) ∆U=А+Q; Г.) ∆U=А-Q; Д.) ∆U = Q-A.
2.03. Який процес відбувся в ідеальному газі, якщо зміна його внутрішньої енергії дорівнює нулю?
А.) ізобарний; Б.) ізотермічний; В.) ізохорний; Г.) адіабатичний.
2.04. Ідеальному газу передається кількість теплоти таким чином, що в будь-який момент часу кількість теплоти Q, що передається, дорівнює роботі А, що здійснюється газом. Який процес здійснюється?
А.) адіабатичний; Б.) ізобарний; В.) ізохорний; Г.) ізотермічний.
2.05. Яка фізична величина обчислюється за формулою?
А) кількість теплоти в ідеальному газі;
Б) тиск ідеального газу;
В) внутрішня енергія одноатомного ідеального газу;
Г.) внутрішня енергія одного молячи ідеального газу.
2.06. Серед наведених нижче формул знайдіть ту, за якою обчислюється максимальне значення ККД теплового двигуна.
А.) 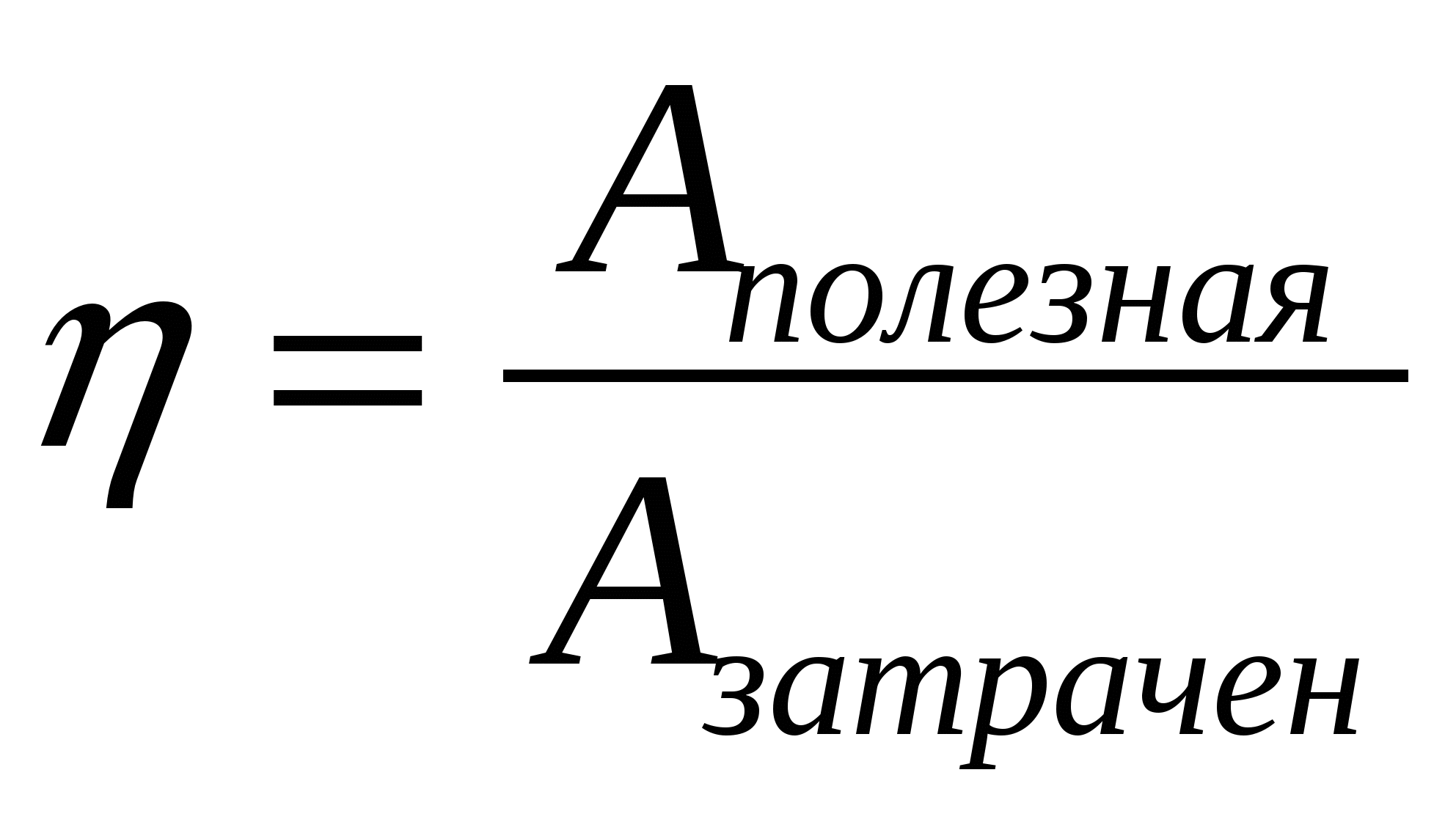 ; Б.)
; Б.)  ; В.)
; В.) 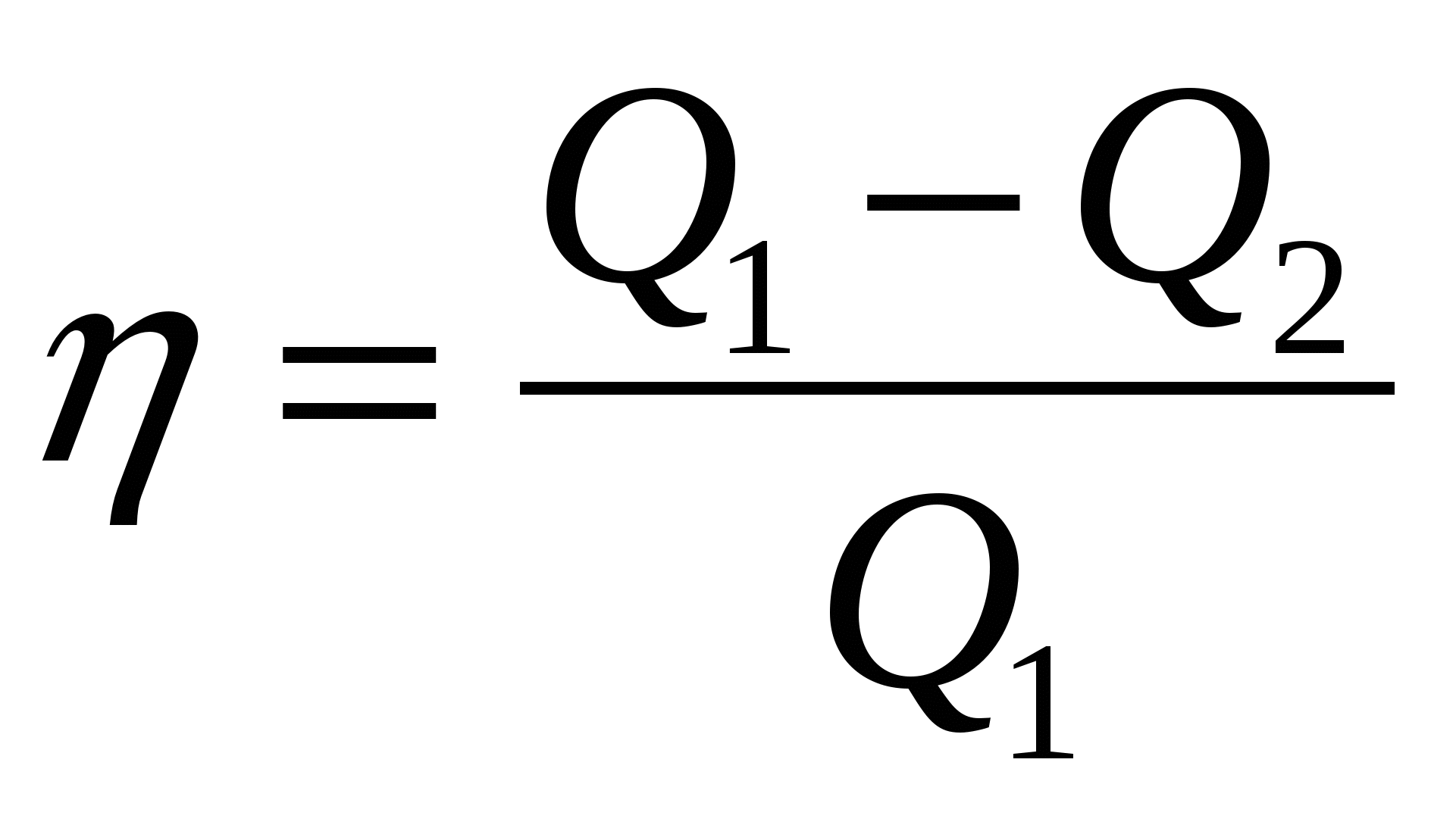 ; Р.)
; Р.)  .
.
2.07. Який процес відбувся в ідеальному газі, якщо зміна його внутрішньої енергії дорівнює кількості підведеної теплоти.
А.) ізобарний; Б.) ізотермічний; В.) ізохорний; Г.) адіабатний.
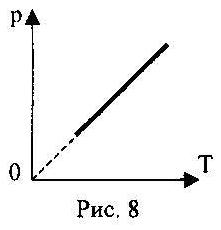 2.08. На рис.8 показано графік ізопроцесу з ідеальним газом. Запишіть перший закон термодинаміки.
2.08. На рис.8 показано графік ізопроцесу з ідеальним газом. Запишіть перший закон термодинаміки.
А.) ∆U=Q+А / ;
Б.) ∆U = А /;
2 .09. На рис. 9 зображені графіки адіабати та ізотерми для деякої маси газу. Яка з цих двох кривих є адіабатою?
.09. На рис. 9 зображені графіки адіабати та ізотерми для деякої маси газу. Яка з цих двох кривих є адіабатою?
А.) 1 – адіабату, 2 – ізотерма;
Б.) 1 – ізотерма, 2 – адіабату;
В) правильної відповіді немає.
2.10. При швидкому стисканні газу циліндрі його температура підвищилася. Чи зміниться при цьому внутрішня енергія газу? Напишіть рівняння першого закону термодинаміки цього випадку.
А.) енергія зменшилася Q=∆U+А/;
Б.) енергія збільшилася ∆U=-А/;
В.) Енергія не змінилася Q = А / .
2.11. Визначте внутрішню енергію двох молей одноатомного (ідеального) газу, взятого за температури 300 К.
А.) 2,5 кДж; Б) 2,5 Дж; Ст) 4,9 Дж; Р.) 4,9 кДж; Д.) 7,5 кДж.
2.12. Чому дорівнює зміна внутрішньої енергії одного моля ідеального одноатомного газу, якщо Т1 = Т, а Т2 = 2Т?
А.) RТ; Б.) 2RТ; В.) 3RТ; Р.) 1,5 RТ.
2.13. Яку роботу здійснює газ, розширюючись ізобарно при тиску 2 ∙ 10 5 Па від об'єму V 1 =0,1 м 3 до об'єму V 2 =0,2 м 3 ?
А.) 2 ∙ 10 6 Дж; Б) 200 кДж; В.) 0,2 ∙ 10 5 Дж.
2.14. Термодинамічній системі передано кількість теплоти, що дорівнює 2000 Дж, і над нею виконано роботу 500 Дж. Визначте зміну його внутрішньої енергії цієї системи.
А.) 2500 Дж; Б) 1500 Дж; В.) ∆U=0.
2.15. У камері, в результаті згоряння палива виділилася енергія, що дорівнює 600 Дж, а холодильник отримав енергію, що дорівнює 400 Дж. Яку роботу здійснив двигун?
А.) 1000 Дж; Б) 600 Дж; Ст) 400 Дж; Р.) 200 Дж.
2.16. При ізобарному нагріванні деякої маси кисню на ∆Т=160 К виконано роботу 8,31 Дж щодо збільшення його обсягу. Визначте масу кисню, якщо М=3,2 ∙ 10 -2 кг/моль, R=8,31 Дж/(К ∙ моль).
А) 0,2 кг; Б) 2 кг; В) 0,5 кг; Р.) 0,2 р.
2.17. Який максимальний ККД теплової машини, яка використовує нагрівач із температурою 427 0 С та холодильник із температурою 27 0 С?
А) 40%; Б) 6%; В.) 93%; р) 57%.
2.18. Температура нагрівача ідеального теплового двигуна 425 К, а холодильника – 300 К. Двигун отримує від нагрівача 4 ∙ 10 4 Дж теплоти. Розрахувати роботу, яку виконує робоче тіло двигуна.
А.) 1,2 ∙ 10 4 Дж; Б.) 13,7 ∙ 10 4 Дж; В.) розрахувати роботу не можна.
2.19. У циліндрі під поршнем знаходиться повітря масою 29 кг. Яку роботу здійснить повітря при ізобарному розширенні, якщо температура його збільшилася на 100 К. Масу поршня не враховувати.
А.) 831 Дж; Б) 8,31 кДж; В.) 0,83 МДж.
2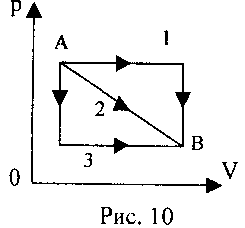 .20. Ідеальний газ із стану А перетворюється на стан У (див. рис. 10) трьома різними шляхами. У якому разі робота газу була максимальною?
.20. Ідеальний газ із стану А перетворюється на стан У (див. рис. 10) трьома різними шляхами. У якому разі робота газу була максимальною?
2.21. З якої висоти впала крижинка, якщо вона нагрілася на 1 К? Вважати, що у нагрівання крижинки йде 60% її потенційної енергії.
А.) 350 м; Б) 700 М; Ст) 210 м.
2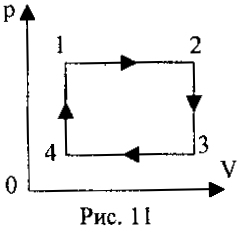 .22. На рис. 11 зображено круговий процес деякої маси ідеального газу. Вкажіть, на яких стадіях газ отримував тепло.
.22. На рис. 11 зображено круговий процес деякої маси ідеального газу. Вкажіть, на яких стадіях газ отримував тепло.
А.) 1-2 та 2-3;
Б.) 3-4 та 4-1;
В.) 1-2 та 4-1;
Г.) 2-3 та 3-4.
2.23. Газ у кількості 1 моль здійснює цикл, що складається з 2 ізохор та 2 ізобар. Найменший об'єм газу 10 л, найбільший – 20 л. Найменший тиск 2,5 атм, найбільший – 5 атм. Знайдіть роботу за цикл.
А.) 2,5 кДж; Б) 5 кДж; В.) 100 кДж; Р.) 2,5 Дж.
2.24. Неон, що знаходився за нормальних умов у закритій посудині ємністю 20 л, охолодили на 91 К. Знайти зміну внутрішньої енергії газу та кількість відданої їм теплоти.
А.) 1 МДж; Б) 0,6 кДж; В.) 1,5 кДж; Р.) 1 кДж.
2.25. Газ здійснює цикл Карно. Абсолютна температура нагрівача в 3 рази більша абсолютної температурихолодильника. Визначте частку теплоти, що віддається холодильнику.
А.) 1/2; Б) 1/3; В.) 1/5; Р.) 2/3.
2.26. Газ здійснює цикл Карно. Температура нагрівача Т 1 =380 К, холодильника Т 2 =280 К. У скільки разів збільшиться коефіцієнт корисної дії циклу, якщо температуру нагрівача збільшити на ∆Т=200 К.
А.) у 2 рази; Б.) у 3 рази; В.) у 1,5 рази; Г.) у 2,5 рази.
2.27. З однакової висоти на кахельну підлогу падають три кульки однакової маси - мідна, сталева та залізна. Який з них нагріється до більш високої температури. Питома теплоємність міді 400 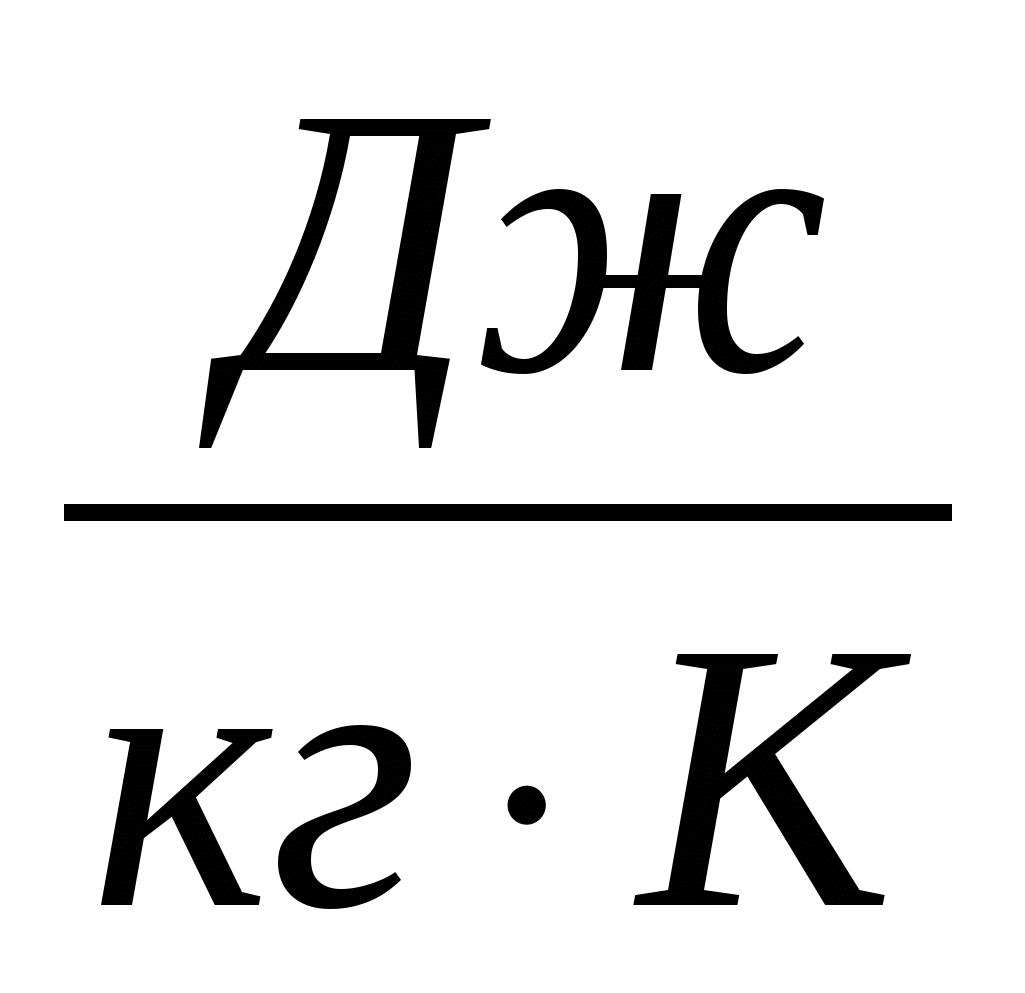 , заліза 460 і 500 стали.
, заліза 460 і 500 стали.
А.) мідний; Б.) сталевий; Ст) залізний.
2.28. Ідеальний газ розширюється згідно із законом 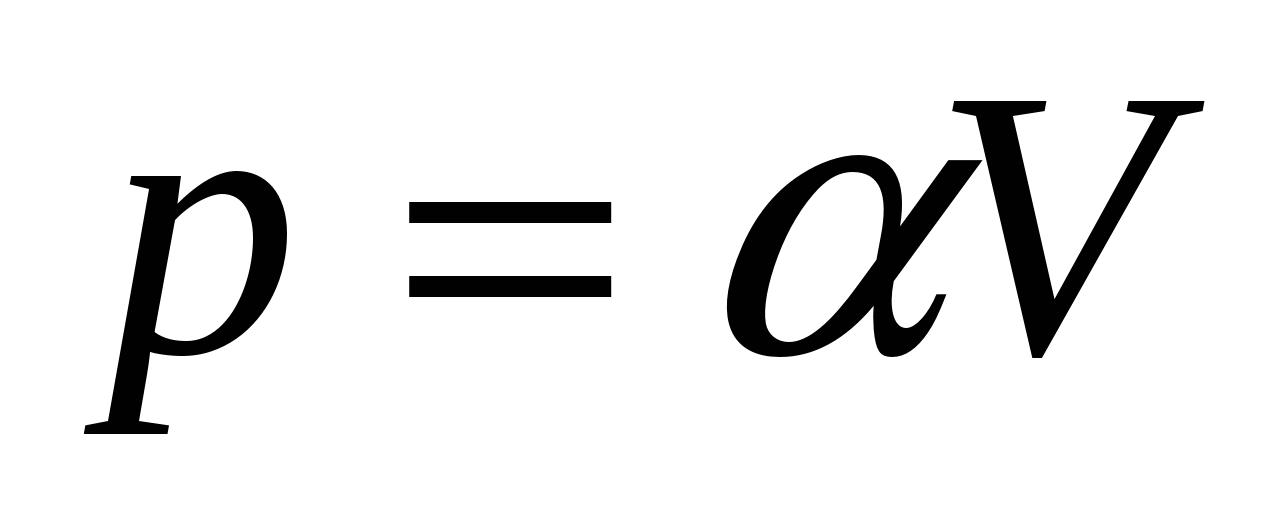 . Знайдіть графічно роботу, виконану газом зі збільшенням обсягу від V 1 до V 2 .
. Знайдіть графічно роботу, виконану газом зі збільшенням обсягу від V 1 до V 2 .
А.) 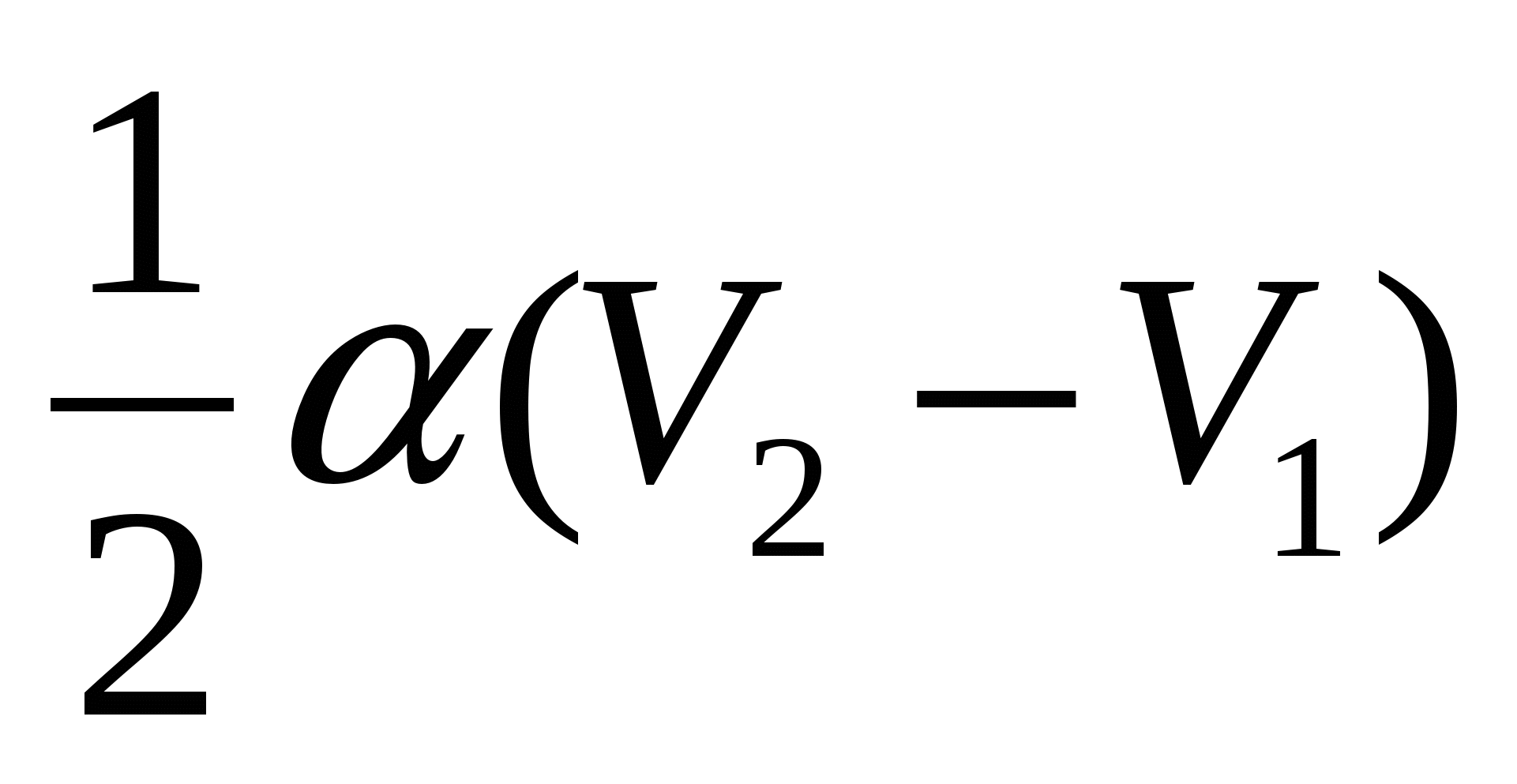 ; Б.)
; Б.) 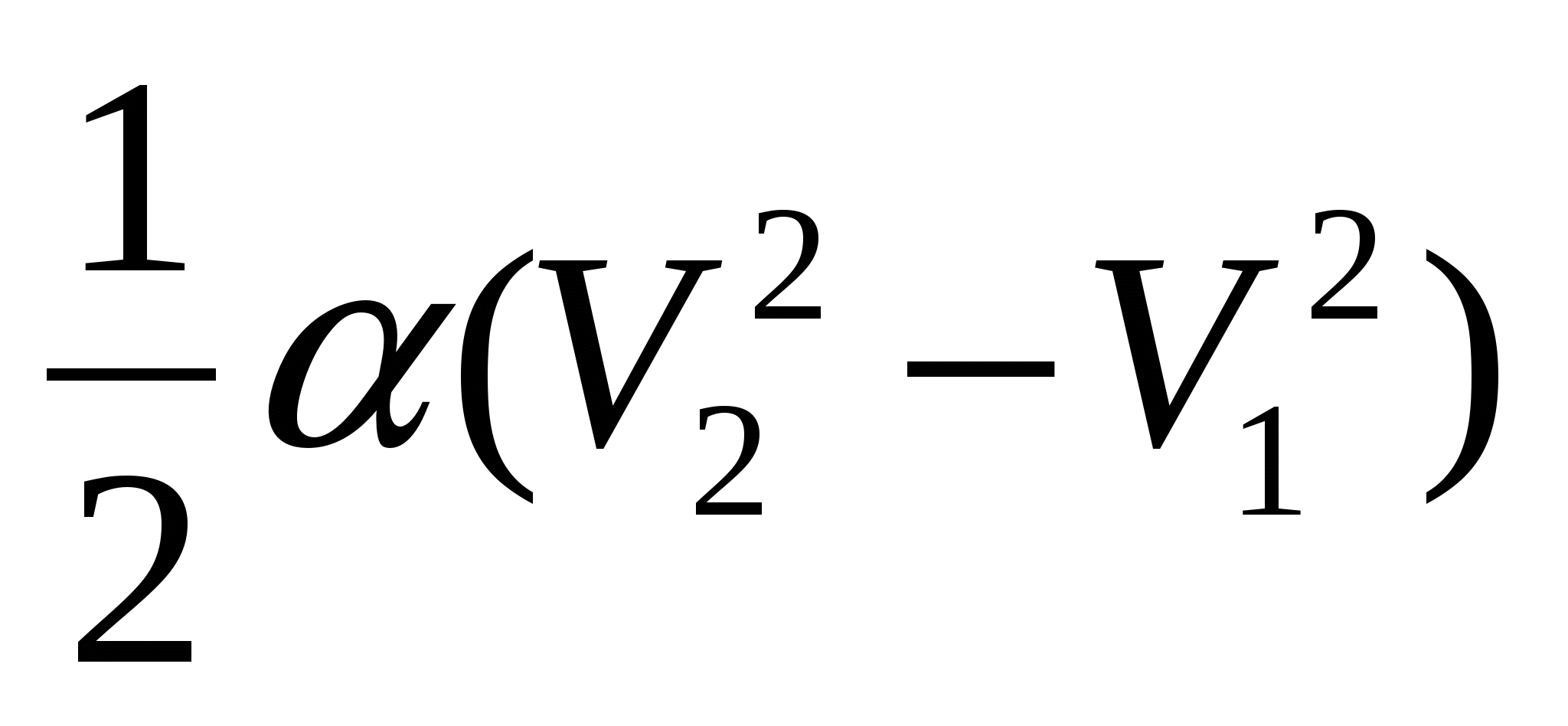 ; В.)
; В.)  .
.
2.29. У циліндрі компресора стискають 4 молячи ідеального одноатомного газу. На скільки піднялася температура газу, якщо було виконано роботу 500 Дж? Процес вважати адіабатним.
А.) 80 К; В.) 10 К; Ст) 50 До.
2.30. Газ здійснює цикл Карно. 70% отриманої теплоти від нагрівача віддає холодильнику. Температура нагрівача 430 К. Визначте температуру холодильника.
А.) 3 К; Б.) 301 К; В.) 614 До.
Ключі правильних відповідей
| Рівень завдань | Номери завдань та правильні відповіді |
|||||||||
| 1 рівень (1 бал) | 2.01 | 2.02 | 2.03 | 2.04 | 2.05 | 2.06 | 2.07 | 2.08 | 2.09 | 2.10 |
| А | У | Б | Г | У | Г | У | У | Б | Б |
|
| 2 рівень (2 бали) | 2.11 | 2.12 | 2.13 | 2.14 | 2.15 | 2.16 | 2.17 | 2.18 | 2.19 | 2.20 |
| Д | Г | У | А | Г | Г | Г | А | У | А |
|
| 3 рівень (3 бали) | 2.21 | 2.22 | 2.23 | 2.24 | 2.25 | 2.26 | 2.27 | 2.28 | 2.29 | 2.30 |
| А | У | А | Г | Б | А | А | Б | Б | Б |
|
2.1.2 Ідеальний газ. Тиск та температура газу. Шкала температур
У молекулярно-кінетичній теорії користуються ідеалізованою моделлюідеальногогазу, згідно з якою:
1) власний обсяг молекул газу дуже малий в порівнянні з обсягом судини;
2) між молекулами газу відсутні сили взаємодії;
3) зіткнення молекул газу між собою та зі стінками судини абсолютно пружні. Модель ідеального газу можна використовувати при вивченні реальних газів, так як вони в нормальних умовах близькі за своїми властивостями вимогам, що пред'являються моделлю ідеального газу.
Справді, роблячи безладні рухи, молекули газу іноді наближаються до стінок судини чи поверхні інших тіл досить малі відстані. Так само молекули можуть підійти один до одного досить близько і між молекулами газу або між молекулою газу і молекулами речовини стінки виникають сили взаємодії, які дуже швидко зменшуються з відстанню. Під дією цих сил молекули газу змінюють напрямок свого руху. Цей процес (зміни напряму), як відомо, називається зіткненням.
Зіткнення молекул відіграють дуже велику роль у стані газу. І ми їх згодом детально вивчимо. Зараз важливо врахувати зіткнення молекул зі стінками судини або з будь-якою іншою поверхнею, що торкається газу. Саме взаємодією молекул газу та стінок визначається сила, яка випробовується стінками з боку газу, яку прийнято характеризувати. тискомр,тобто силою F, віднесеної до одиниці площі Sповерхні стінки, нормальної до цієї стінки:
|
p = F/ S |
Властивість газу чинити тиск на стінки судини, що містить його, - одна з основних властивостей газу. Саме своїм тиском газ найчастіше і виявляє свою присутність. Тому величина тиску є однією з основних показників газу.
Припустимо, що газ укладено в посудину, що має форму паралелепіпеда (рисунок - 2.4), і що газ перебуває у стані рівноваги. Обчислимо тиск газу одну зі стінок судини, наприклад на праву бічну стінку abed. Направимо координатну вісь X вздовж ребра паралелепіпеда перпендикулярно до стінки abed, як це показано малюнку - 2.4). Як би не були спрямовані швидкості v молекул, нас цікавитимуть лише проекції v x швидкостей молекул на вісь X: у напрямку до стінки abed молекули рухаються саме із швидкістю v x .
|
Малюнок – 2.4 |
Виділимо подумки шар газу завтовшки Δх,прилеглий до вибраної стінки. На нього з боку деформованої стінки діє пружна сила F. З такою ж за абсолютним значенням силою і газ діє на стінку. За другим законом Ньютона імпульс сили F∆ t (де ∆ t - Деякий довільний проміжок часу) дорівнює зміні імпульсу газу в нашому шарі. Але газ перебуває в стані рівноваги, так що шар ніякого збільшення імпульсу в напрямку імпульсу сили (проти позитивного напрямку осі X) не отримує. Відбувається це тому, що через молекулярні рухи виділений шар отримує імпульс протилежного напрямку і, звичайно, такий же за абсолютним значенням. Його неважко вирахувати.
При безладних рухах газових молекул за час ∆ t до нашого шару зліва направо входить деяка кількість молекул і стільки ж молекул виходять з нього в зворотному напрямку- справа наліво. Вхідні молекули несуть із собою певний імпульс. Виходять з виділеного обсягу, молекули несуть такий самий імпульс протилежного знака, так що загальний імпульс, що отримується шаром, дорівнює сумі алгебри імпульсів входять в шар і виходять з нього молекул. Знайдемо число молекул, що входять до нашого шару зліва за час ∆ t.
За цей час до кордону a" b" c" d" ліворуч можуть підійти ті молекули, які знаходяться від неї на відстані, що не перевищує v x ∆ t. Всі вони знаходяться в обсязі паралелепіпеда з площею основи S(це площа стіни, що розглядається) і довжиною v x ∆ t, тобто в обсязі Sv x ∆ t. Якщо одиниці обсягу посудини міститься пмолекул, то в зазначеному обсязі знаходиться nSv x ∆ t молекул. Але з них лише половина рухається ліворуч і потрапляє в шар. Інша половина рухається від нього і до шару не потрапляє. Отже, за час ∆ tу шар зліва направо входить 1/2 nSv∆ t молекул. Кожна з них має імпульс mv x, і загальний імпульс, який вони вносять у шар, дорівнює 1/2 nmv x 2 S ∆ t. За цей же час шар залишає, рухаючись праворуч наліво , таке ж число молекул з таким самим загальним імпульсом, але зворотного знака. Таким чином, через приход у шар молекул з позитивним імпульсом і відходу з нього молекул з негативним імпульсом загальна зміна імпульсу шару дорівнює 1/2 nmv x 2 S ∆ t – (-1/2 nmv x 2 S ∆ t) = nmv x 2 S ∆ t. Це зміна імпульсу шару і компенсує ту зміну, яка мала б статися під впливом імпульсу сили F At. Тому ми можемо написати: F ∆ t = nmv x 2 S ∆ t. Розділивши обидві частини цієї рівності на S ∆ t, отримуємо: p = F/ S = nmv x 2 . Досі ми мовчки припускали, що всі молекули газу мають однакові проекції швидкості v x . Насправді це, звісно, негаразд. І швидкості молекул v, та їх проекції v x на вісь X у різних молекул, очевидно, різні. Врахуємо відмінність швидкостей молекул та їх проекцій на осі координат тим, що замінимо величину v x 2 , що входить в останню формулу, її середнім значенням ‹ v x 2 ›, так що формулі для тиску газу ми надамо вигляду: p = nm‹ v x 2 ›. Для швидкості v кожної молекули можна написати: v 2 = v x 2 +- v 2 y + v z 2 :
|
‹ v x 2 › = ‹ v x 2 ›+‹ v 2 y ›+‹ v z 2 ›. |
Через повну безладність молекулярних рухів можна вважати, що середні значення квадратів проекцій швидкостей на три осі координат дорівнюють один одному, тобто, ‹ v x 2 ›= v 2 y ›=‹ v z 2 ›. А це означає, що ‹ v x2 ›= v2/3.Підставивши цей вираз у формулу Обчислимо тиск газу на одну зі стінок тиску отримуємо: р = mv 2 /3 , або, помноживши і розділивши праву частину цієї рівності на двійку, знайдемо
|
р = 2/3nmv 2 /2 |
Наведені прості міркування справедливі для будь-якої стінки судини і для будь-якого майданчика, який подумки можна помістити в газ. У всіх випадках ми отримаємо тиск газу результат, виражений останньою формулою. Величина mv 2 /2 у ній є середню кінетичну енергію однієї молекули газу. Отже, тиск газу дорівнює двом третинам середньої кінетичної енергії молекул, що містяться в одиниці об'єму газу.Це - один із найважливіших висновків кінетичної теорії ідеального газу. Він встановлює зв'язок між молекулярними величинами, тобто величинами, що належать до окремої молекули, і макроскопічною характеристикою газу - величиною тиску, що характеризує газ як ціле, - величиною, що безпосередньо вимірюється на досвіді. Рівняння (2.9) називають основним рівнянням кінетичної теорії ідеальних газів. Важливо підкреслити, що тиск газу визначається середньою кінетичною енергією його молекул. Це означає, що тиск газу - величина, пов'язана з тим, що газ складається з великої кількості молекул.
Одним із важливих термодинамічних параметрів, що характеризують стан газу, є температура. Температура грає значної ролі у термодинаміці, а й у фізиці загалом. Якщо тіло або система тіл не знаходиться в стані теплової рівноваги і якщо система ізольована (не взаємодіє з іншими тілами), через деякий час стан теплової рівноваги встановлюється само собою. Стан теплової рівноваги - це і є стан, який переходить будь-яка ізольована система.
Однією з ознак стану теплової рівноваги є рівність температур всіх частин тіла або всіх тіл системи. Відомо, що у процесі встановлення теплової рівноваги, тобто. при вирівнюванні температури двох тіл відбувається передача теплоти від одного тіла іншому. Отже, з експериментальної точки зору, температура тіла - це величина, яка визначає, чи воно іншому тілу з іншою температурою передаватиме теплоту або отримувати від нього теплоту.
Цей простий досвід показує, що температура - це величина, що характеризує стан теплової рівноваги: у тіл, що перебувають у стані теплової рівноваги, однакові температури. І навпаки, тіла з однаковою температурою перебувають у тепловій рівновазі одне з одним. А якщо два тіла знаходяться в тепловій рівновазі з якимось третім тілом, то обидва тіла знаходяться в тепловій рівновазі і між собою. Це важливе твердження є одним із основних законів природи. Температура- Фізична величина, що характеризує стан термодинамічної рівноваги макроскопічної системи.
Для вимірювання температури здавна користуються тим, що при зміні температури тіла змінюються та його властивості. Змінюються, отже, величини, що характеризують ці властивості. Тому, для створення термометра, вибирають якусь речовину (термометрична речовина) та певну величину, що характеризує властивість речовини (термометричну величину). Вибір того й іншого цілком довільний. У побутових термометрах, наприклад, термометричною речовиною є ртуть, а термометричною величиною – довжина ртутного стовпчика.
Для того, щоб величині температури можна було зіставити певні числові значення, потрібно ще задатися тією чи іншою залежністю термометричної величини від температури. Вибір цієї залежності теж довільний: адже поки що немає термометра, не можна досвідченим шляхом встановити цю залежність. У разі ртутного термометра, наприклад, обирається лінійна залежність довжини стовпчика ртутного (об'єму ртуті) від температури.
Залишається встановити одиницю температури - градус (хоча в принципі її можна було б виражати в тих же одиницях, в яких вимірюється термометрична величина, наприклад по ртутному термометру - в сантиметрах). Величина градуса обирається теж довільно (як і термометричне речовина, і вид функції, що зв'язує термометричну величину з температурою).
Розмір градуса встановлюється в такий спосіб. Вибирають, знову-таки довільно, дві температури (їх називають реперними точками) - зазвичай це температури танення льоду та кипіння води при атмосферному тиску- і ділять цей температурний інтервал на деяке (теж довільне) число рівних частин - градусів, а одній із цих двох температур приписують певне числове значення. Тим самим визначається значення другої температури та будь-якої проміжної. Таким чином, отримують температурну шкалу
Сучасна термометрія заснована на шкалою ідеального газу, встановлюється за допомогою газового термометра У принципі газовий термометр - це закритий посуд, наповнений ідеальним газом і з манометром для вимірювання тиску газу. Термометричною речовиною в такому термометрі є ідеальний газ, а термометричною величиною - тиск газу при постійному обсязі. Вимірювання температури проводиться побічно щодо зміни тиску газу в посудині 1 при постійному обсязі Це дозволяє прийняти, що відношення тисків при температурах кипіння води ( р до) та танення льоду (р 0 ) дорівнює відношенню самих цих температур: р до / р 0 = Т до / Т 0
Ставлення р до / р 0 легко визначити з досвіду. Численні виміри показали, що р до / р 0 = 1,3661. Отже, отже, і значення відношення температур: Т до /Т 0 = 1,3661. Розмір градуса вибирається поділом різниці Т до - Т 0 на сто частин: Т до - Т 0 =100.
З останніх двох рівностей випливає, що температура танення льоду Т 0 за обраною нами шкалою дорівнює 273,15 градусів, а температура кипіння води Т до дорівнює 373,15 градусів. Для того щоб за допомогою газового термометра виміряти температуру якогось тіла, треба привести тіло в контакт з газовим термометром і, дочекавшись рівноваги, виміряти тиск ргазу у термометрі. Тоді температура тіла Твизначається за формулою
|
Т = 273,15(р/р 0 ) |
де р 0 -- тиск газу в термометрі, поміщеному в лід, що тане. Так можна отримати термометричну шкалу емпіричним методом емпіричну шкалу температур. У практиці газовим термометром користуються дуже рідко. На нього покладено найбільш відповідальну роль - по ньому градуюються всі вживані термометри. Таким можна отримати безліч різних термометрів і температурних шкал.
Створення хороших термометрів та вимірювання температури, особливо в широкому діапазоні її зміни, завдання не прості. Виміряти температуру якогось тіла - значить порівняти її з температурою зразка. Природно, за еталон вибрати ідеальний газ, так як температура такого газу легко визначається через макропараметри, такі, як об'єм або тиск. Причому якщо одна з цих величин фіксується, то інша для цієї маси газу змінюється лінійно зі зміною температури Т.Щоб температури двох тіл, що досліджується та еталонного, стали рівними, необхідно привести їх у теплову рівновагу.
Газові термометри використовуються зазвичай як первинні прилади, якими градуюють вторинні термометри, що застосовуються безпосередньо в експериментах. З вторинних термометрів найбільшого поширення набули рідинні термометри, термометри опору та термоелементи.
Найпростішими термометрами є рідинні термометри, де термометричним тілом є ртуть або етиловий спирт. Ртутний термометр є сферичний або циліндричний скляний резервуар, до якого припаяний тонкий капіляр зі скла того ж сорту. Відлік температури провадять за шкалою, прикріпленою до капіляра (рисунок - 2.5). Зазвичай рідинні термометри застосовують у діапазоні температур від 125 до 900 К. Нижня межа вимірюваної температури визначається властивостями рідини, верхня - властивостями скла капіляра.
На малюнку - 2.6 зображено ртутний термометр, що складається з невеликого резервуара з ртуттю, що закінчується тонким капіляром. При нагріванні ртуть розширюється, та її рівень h у капілярі піднімається. Шкала та початок відліку температури можуть бути обрані довільно.
|
|
|
|
Малюнок – 2.5 |
Малюнок – 2.6 |
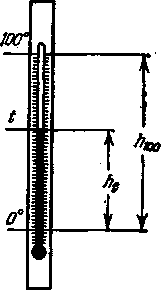
Найбільш поширеною у міжнародній практиці шкалою для вимірювання температури є стоградусна шкала Цельсія.В цьому випадку за нуль температурної шкали (0 ° С) прийнята температура плавлення льоду за нормальних умов, тобто при тиску р= 1 атм,а за 100 ° - температура кипіння води (за тих же умов). Розділивши тоді висоту капіляра h 100 між цими двома точками на 100 рівних частин можна визначити температуру t у градусах Цельсія щодо висоти підняття ртуті в капілярі h t до інтервалу між двома постійними точками, тобто.
Таке визначення температури придатне лише грубих вимірювань у побуті. При точніших вимірах. виявляється, що для різних термометричних рідин, наприклад для ртутного та спиртового термометрів, при однаковій температурі чисельні значення відношень h 1 / h 100 - збігаються один з одним лише для обраних постійних точок. При проміжних температурах показання обох термометрів будуть дещо розходитися, так як закони розширення різних рідин і судин, що їх містять різні.
У сучасній техніці найзручнішими є електричні методи вимірювання температури. У так званих термометрах опорувикористовується зміна опору металів та напівпровідників при їх нагріванні. Термоелементамиабо термопарамивимірюється електрорушійна сила, що виникає при нагріванні місця контакту двох металів або напівпровідників.
У термометрах опору термометричним тілом є метал чи напівпровідник, опір якого змінюється з температурою. Зміна опору з температурою вимірюють за допомогою мостових схем (рисунок – 2.7). Термометри опору з металів застосовуються в інтервалі температур від 70 до 1300 К, напівпровідників (термістори) - в інтервалі від 150 до 400 К, а вуглецеві - до температур рідкого гелію.
За будь-якого методу визначення температури на температурній шкалі можна відзначити деяку точку, що має абсолютне значення. Ця точка відповідає температурі, за якої відсутній хаотичний (тепловий) рух молекул, і носить назву абсолютного нуля температури (Т= 0 ° С = 0 ° К).У разі ідеального газу значенням Т= 0 відповідає відсутність кінетичної енергії поступального руху молекул та відсутність тиску. Така шкала для вимірювання температури називається абсолютною шкалою, одиницею вимірювання служить градус Кельвіна ( До). Не слід думати, що з абсолютному нулі температури припиняється всяке рух частинок речовини. Навіть якщо всі молекули газу зупиняться, то всередині них рухатимуться електрони по певних орбітах навколо ядер, певним чином братимуть участь у русі протони та нейтрони всередині ядер. Нижче ми переконаємося, що, наприклад, середня кінетична енергія вільних електронів у металі при абсолютному нулі в сотні разів перевищує середню кінетичну енергію молекул газу за кімнатної температури тощо.