«Физика - 10 класс»
Состояние какого газа описывает уравнение Менделеева-Клапейрона.
Можно ли универсальную газовую постоянную считать фундаментальной постоянной?
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трёх параметров - давление, объём или температура - остаются неизменными.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего называют газовыми законами .
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами .
Слово «изопроцесс» - сложное слово, первая часть которого происходит от греческого слова isos - равный, одинаковый.
Отметим, что в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объёма. Лишь в лабораторных условиях удаётся поддерживать постоянство того или иного параметра с высокой точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс - это идеализированная модель реального процесса, которая только приближённо отражает действительность.
Изотермический процесс.
Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим .
Слово «изотермический» происходит от греческих слов isos - равный, одинаковый и therme - теплота.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплом с большой системой - термостатом. Иначе при сжатии или расширении температура газа будет меняться. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса. Согласно уравнению состояния идеального газа (10.4), если масса газа не изменяется, в любом состоянии с неизменной температурой произведение давления газа на его объём остаётся постоянным:
pV = const при Т = const. (10.6)
Этот вывод был сделан английским учёным Р. Бойлем (1627-1691) и несколько позже французским учёным Э. Мариоттом (1620-1684) на основе эксперимента. Поэтому он носит название закона Бойля-Mapuoттa .
Для газа данной массы произведение давления газа на его объём постоянно.
Закон Бойля-Мариотта справедлив обычно для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Кривую, изображающую зависимость давления газа от объёма при постоянной температуре, называют изотермой .
Изотерма газа изображает обратно пропорциональную зависимость между давлением и объёмом. Кривую такого рода в математике называют гиперболой (рис. 10.1).
Различным постоянным температурам соответствуют различные изотермы. При повышении температуры газа давление согласно уравнению состояния (10.4) увеличивается, если V = const. Поэтому изотерма, соответствующая более высокой температуре Т 2 , лежит выше изотермы, соответствующей более низкой температуре Т 1 (см. рис. 10.1).
Для того чтобы процесс происходил при постоянной температуре, сжатие или расширение газа должно происходить очень медленно. Дело в том, что, например, при сжатии газ нагревается, так как при движении поршня в сосуде скорость и соответственно кинетическая энергия молекул после ударов о поршень увеличиваются, а следовательно, увеличивается и температура газа. Именно поэтому для реализации изотермического процесса надо после небольшого смещения поршня подождать, когда температура газа в сосуде опять станет равной температуре окружающего воздуха.
Кроме этого, отметим, что при быстром сжатии давление под поршнем сразу становится больше, чем во всём сосуде. Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии и мы не можем назвать значения температуры и давления, определяющие в данный момент состояние системы. Если систему предоставить самой себе, то температура и давление постепенно выравниваются, система приходит в равновесное состояние.
Равновесное состояние - это состояние, при котором температура и давление во всех точках объёма одинаковы.
Параметры состояния газа могут быть определены, если он находится в равновесном состоянии.
Процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом .
Очевидно, что на графиках зависимости одного параметра от другого мы можем изображать только равновесные процессы.
Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным .
Слово «изобарный» происходит от греческих слов isos - равный, одинаковый и baros - вес, тяжесть.
Согласно уравнению (10.4) в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным:
Этот закон был установлен экспериментально в 1802 г. французским учёным Ж. Гей-Люссаком (1778-1850) и носит название закона Гей-Люссака .
Закона Гей-Люссака:
Для газа данной массы при постоянном давлении отношение объёма к абсолютной температуре постоянно.
Согласно уравнению (10.7) объём газа при постоянном давлении пропорционален температуре:
V = const Т. (10.8)
Прямую, изображающую зависимость объёма газа от температуры при постоянном давлении, называют изобарой .
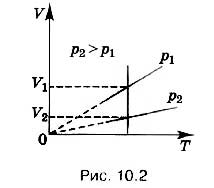
Разным давлениям соответствуют разные изобары (рис. 10.2). Проведём на рисунке произвольную изотерму. С ростом давления объём газа при постоянной температуре согласно закону Бойля- Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р 2 , лежит ниже изобары, соответствующей более низкому давлению p 1 .
В области низких температур все изобары идеального газа сходятся в точке Т = 0. Но это не означает, что объём реального газа обращается в нуль. Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния (10.4) неприменимо. Именно поэтому, начиная с некоторого значения температуры, зависимость объёма от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объёме называют изохорным .
Слово «изохорный» происходит от греческих слов isos - равный, одинаковый и chora - место, пространство, занимаемое чем-нибудь.
Из уравнения состояния (10.4) вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся постоянным:
Этот газовый закон был установлен в 1787 г. французским физиком Ж. Шарлем (1746-1823) и носит название закона Шарля .
Для газа данной массы отношение давления к абсолютной температуре постоянно, если объём не меняется.
Согласно уравнению (10.9) давление газа при постоянном объёме пропорционально температуре:
р = const Т. (10.10)
Прямую, изображающую зависимость давления газа от температуры при постоянном объёме, называют изохорой.
Разным объёмам соответствуют разные изохоры. Также проведём на рисунке произвольную изотерму (рис. 10.3). С ростом объёма газа при постоянной температуре давление его, согласно закону Бойля- Мариотта, падает. Поэтому изохора, соответствующая большему объёму V 2 , лежит ниже изохоры, соответствующей меньшему объёму V 1 .
В соответствии с уравнением (10.10) все изохоры идеального газа начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Увеличение давления газа в любом сосуде или в электрической лампочке при нагревании можно считать изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объёма.
В заключение составим опорную схему (рис. 10.4) и покажем логические переходы связывающие различные законы и уравнения.
2. Основы термодинамики
2.01. При постоянном давлении р объём газа увеличится на ∆V. Какая физическая величина равна произведению р|∆V| в этом случае?
А.) работа, совершаемая газом;
Б.) работа, совершаемая над газом внешними силами;
В.) количество теплоты, полученное газом;
Г.) внутренняя энергия газа.
2.02. Над телом совершена работа А внешними силами, и телу передано количество теплоты Q. Чему равно изменение внутренней энергии ∆U тела?
А.) ∆U=А; Б.) ∆U=Q В.) ∆U=А+Q; Г.) ∆U=А-Q; Д.) ∆U=Q-A.
2.03. Какой процесс произошел в идеальном газе, если изменение его внутренней энергии равно нулю?
А.) изобарный; Б.) изотермический; В.) изохорный; Г.) адиабатический.
2.04. Идеальному газу передаётся количество теплоты таким образом, что в любой момент времени передаваемое количество теплоты Q равно работе А, совершаемой газом. Какой процесс осуществляется?
А.) адиабатический; Б.) изобарный; В.) изохорный; Г.) изотермический.
2.05. Какая физическая величина вычисляется по формуле ?
А.) количество теплоты в идеальном газе;
Б.) давление идеального газа;
В.) внутренняя энергия одноатомного идеального газа;
Г.) внутренняя энергия одного моля идеального газа.
2.06. Среди приведенных ниже формул найдите ту, по которой вычисляется максимальное значение КПД теплового двигателя.
А.) 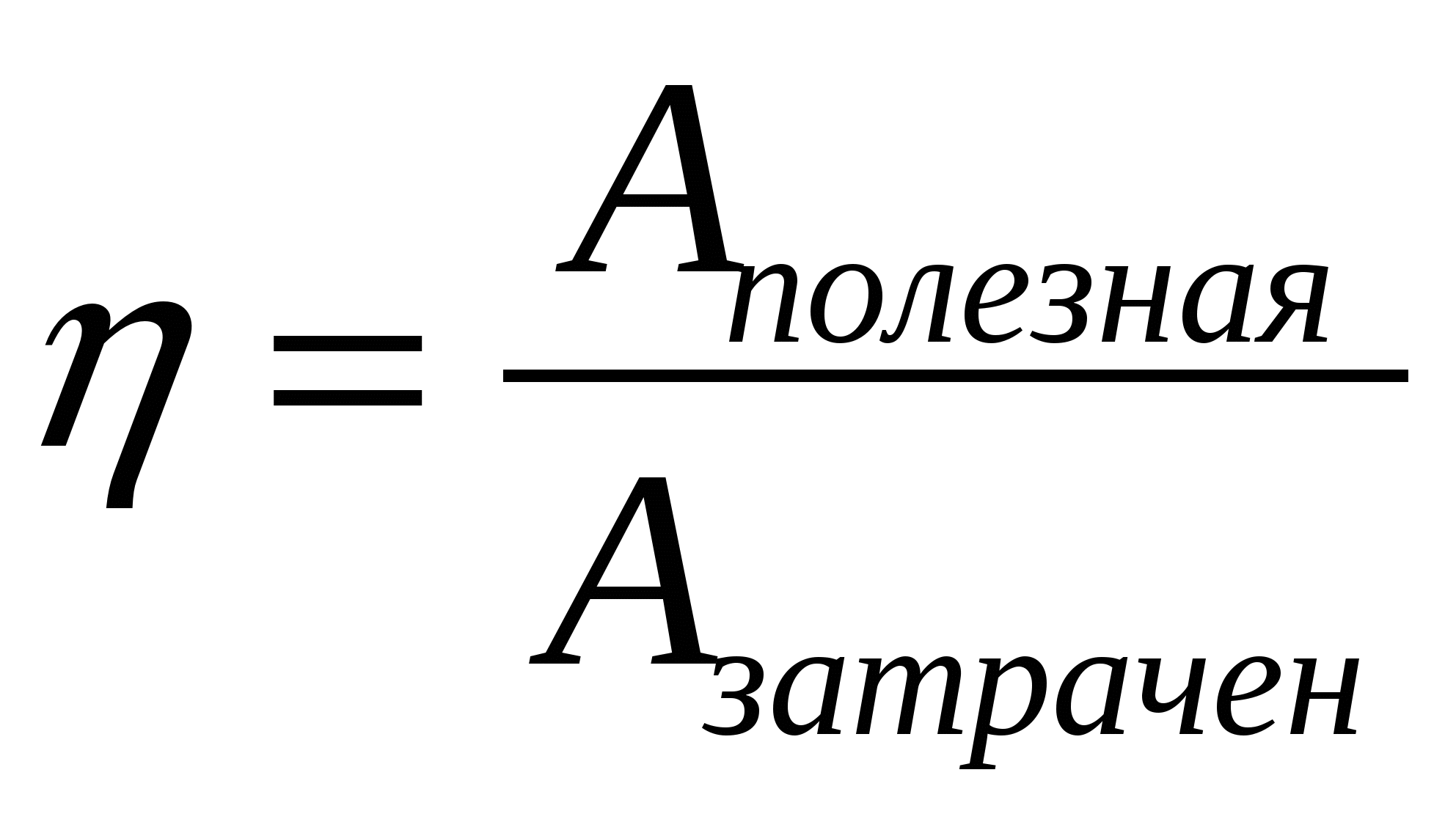 ; Б.)
; Б.)  ; В.)
; В.) 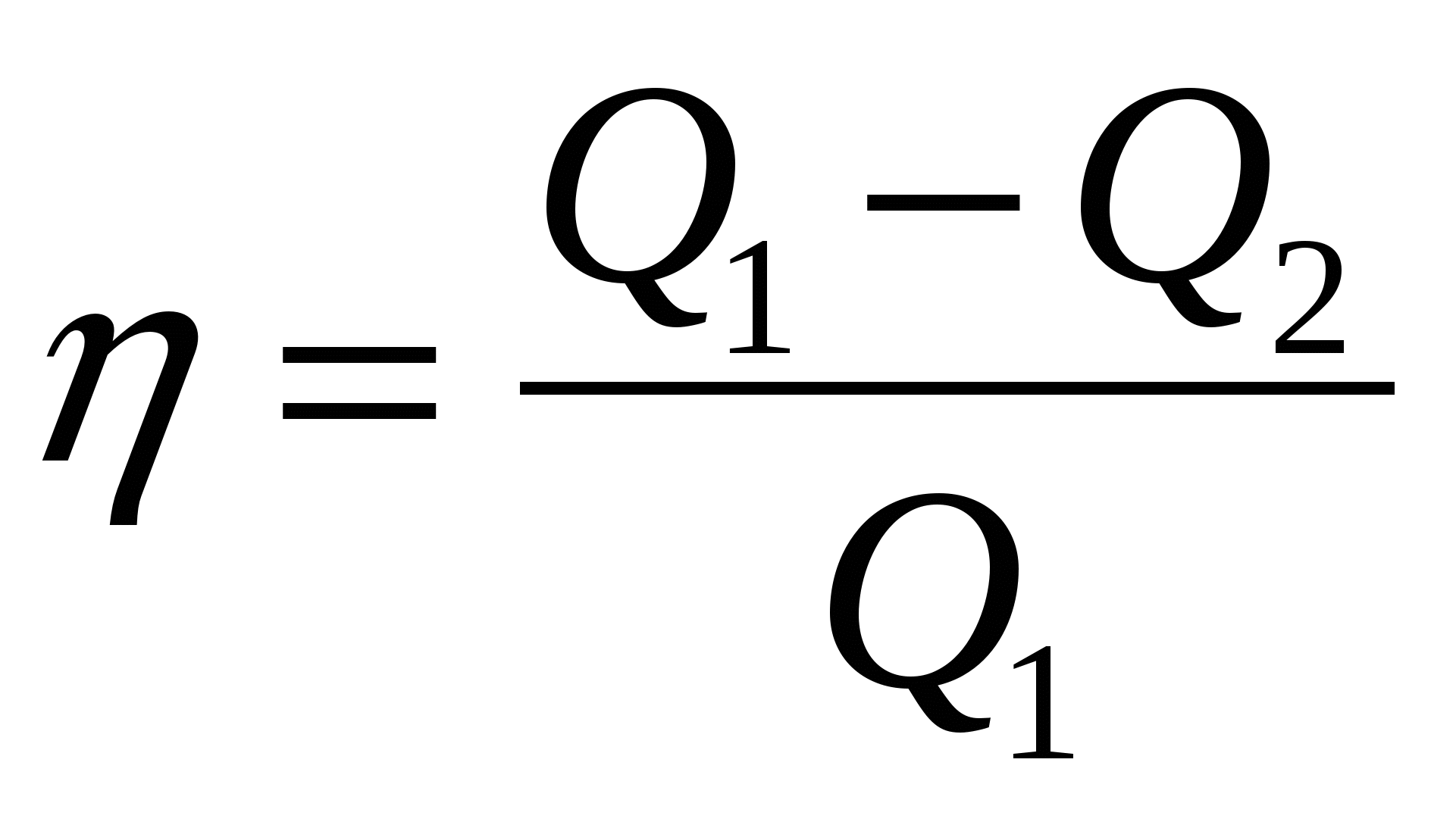 ; Г.)
; Г.)  .
.
2.07. Какой процесс произошел в идеальном газе, если изменение его внутренней энергии равно количеству подведённой теплоты.
А.) изобарный; Б.) изотермический; В.) изохорный; Г.) адиабатный.
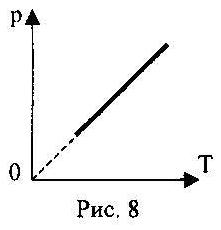 2.08. На рис.8 показан график изопроцесса с идеальным газом. Запишите для него первый закон термодинамики.
2.08. На рис.8 показан график изопроцесса с идеальным газом. Запишите для него первый закон термодинамики.
А.) ∆U=Q+А / ;
Б.) ∆U=А / ;
2 .09. На рис. 9 изображены графики адиабаты и изотермы для некоторой массы газа. Какая из этих двух кривых является адиабатой?
.09. На рис. 9 изображены графики адиабаты и изотермы для некоторой массы газа. Какая из этих двух кривых является адиабатой?
А.) 1 - адиабата, 2 - изотерма;
Б.) 1 - изотерма, 2 - адиабата;
В.) правильного ответа нет.
2.10. При быстром сжатии газа в цилиндре его температура повысилась. Изменится ли при этом внутренняя энергия газа? Напишите уравнение первого закона термодинамики для этого случая.
А.) энергия уменьшилась Q=∆U+А / ;
Б.) энергия увеличилась ∆U=-А / ;
В.) энергия не изменилась Q=А / .
2.11. Определите внутреннюю энергию двух молей одноатомного (идеального) газа, взятого при температуре 300 К.
А.) 2,5 кДж; Б.) 2,5 Дж; В.) 4,9 Дж; Г.) 4,9 кДж; Д.) 7,5 кДж.
2.12. Чему равно изменение внутренней энергии одного моля идеального одноатомного газа, если Т 1 =Т, а Т 2 =2Т?
А.) RТ; Б.) 2RТ; В.) 3RТ; Г.) 1,5RТ.
2.13. Какую работу совершает газ, расширяясь изобарно при давлении 2 ∙ 10 5 Па от объёма V 1 =0,1 м 3 до объёма V 2 =0,2 м 3 ?
А.) 2 ∙ 10 6 Дж; Б.) 200 кДж; В.) 0,2 ∙ 10 5 Дж.
2.14. Термодинамической системе передано количество теплоты, равное 2000 Дж, и над ней совершена работа 500 Дж. Определите изменение его внутренней энергии этой системы.
А.) 2500 Дж; Б.) 1500 Дж; В.) ∆U=0.
2.15. В камере, в результате сгорания топлива выделилась энергия, равная 600 Дж, а холодильник получил энергию, равную 400 Дж. Какую работу совершил двигатель?
А.) 1000 Дж; Б.) 600 Дж; В.) 400 Дж; Г.) 200 Дж.
2.16. При изобарном нагревании некоторой массы кислорода на ∆Т=160 К совершена работа 8,31 Дж по увеличению его объёма. Определите массу кислорода, если М=3,2 ∙ 10 -2 кг/моль, R=8,31 Дж/(К ∙ моль).
А.) 0,2 кг; Б.) 2 кг; В.) 0,5 кг; Г.) 0,2 г.
2.17. Каков максимальный КПД тепловой машины, которая использует нагреватель с температурой 427 0 С и холодильник с температурой 27 0 С?
А.) 40%; Б.) 6%; В.) 93%; Г.) 57%.
2.18. Температура нагревателя идеального теплового двигателя 425 К, а холодильника - 300 К. Двигатель получает от нагревателя 4 ∙ 10 4 Дж теплоты. Рассчитать работу, совершаемую рабочим телом двигателя.
А.) 1,2 ∙ 10 4 Дж; Б.) 13,7 ∙ 10 4 Дж; В.) рассчитать работу нельзя.
2.19. В цилиндре под поршнем находится воздух, массой 29 кг. Какую работу совершит воздух при изобарном расширении, если температура его увеличилась на 100 К. Массу поршня не учитывать.
А.) 831 Дж; Б.) 8,31 кДж; В.) 0,83 МДж.
2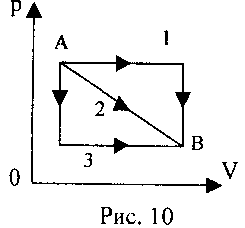 .20. Идеальный газ из состояния А переходит в состояние В (см. рис. 10) тремя различными путями. В каком случае работа газа была максимальной?
.20. Идеальный газ из состояния А переходит в состояние В (см. рис. 10) тремя различными путями. В каком случае работа газа была максимальной?
2.21. С какой высоты упала льдинка, если она нагрелась на 1 К? Считать, что на нагревание льдинки идёт 60% её потенциальной энергии.
А.) 350 м; Б.) 700 М; В.) 210 м.
2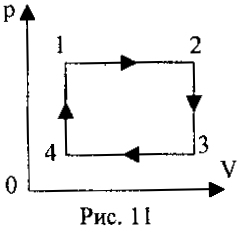 .22. На рис. 11 изображен круговой процесс некоторой массы идеального газа. Укажите, на каких стадиях газ получал тепло.
.22. На рис. 11 изображен круговой процесс некоторой массы идеального газа. Укажите, на каких стадиях газ получал тепло.
А.) 1-2 и 2-3;
Б.) 3-4 и 4-1;
В.) 1-2 и 4-1;
Г.) 2-3 и 3-4.
2.23. Газ в количестве 1 моль совершает цикл, состоящий из 2 изохор и 2 изобар. Наименьший объём газа 10 л, наибольший - 20 л. Наименьшее давление 2,5 атм, наибольшее - 5 атм. Найдите работу за цикл.
А.) 2,5 кДж; Б.) 5 кДж; В.) 100 кДж; Г.) 2,5 Дж.
2.24. Неон, находившийся при нормальных условиях в закрытом сосуде ёмкостью 20 л, охладили на 91 К. Найти изменение внутренней энергии газа и количество отданной им теплоты.
А.) 1 МДж; Б.) 0,6 кДж; В.) 1,5 кДж; Г.) 1 кДж.
2.25. Газ совершает цикл Карно. Абсолютная температура нагревателя в 3 раза больше абсолютной температуры холодильника. Определите долю теплоты, отдаваемую холодильнику.
А.) 1/2; Б.) 1/3; В.) 1/5; Г.) 2/3.
2.26. Газ совершает цикл Карно. Температура нагревателя Т 1 =380 К, холодильника Т 2 =280 К. Во сколько раз увеличится коэффициент полезного действия цикла, если температуру нагревателя увеличить на ∆Т=200 К.
А.) в 2 раза; Б.) в 3 раза; В.) в 1,5 раза; Г.) в 2,5 раза.
2.27. С одинаковой высоты на кафельный пол падают три шарика одинаковой массы - медный, стальной и железный. Какой из них нагреется до более высокой температуры. Удельная теплоемкость меди 400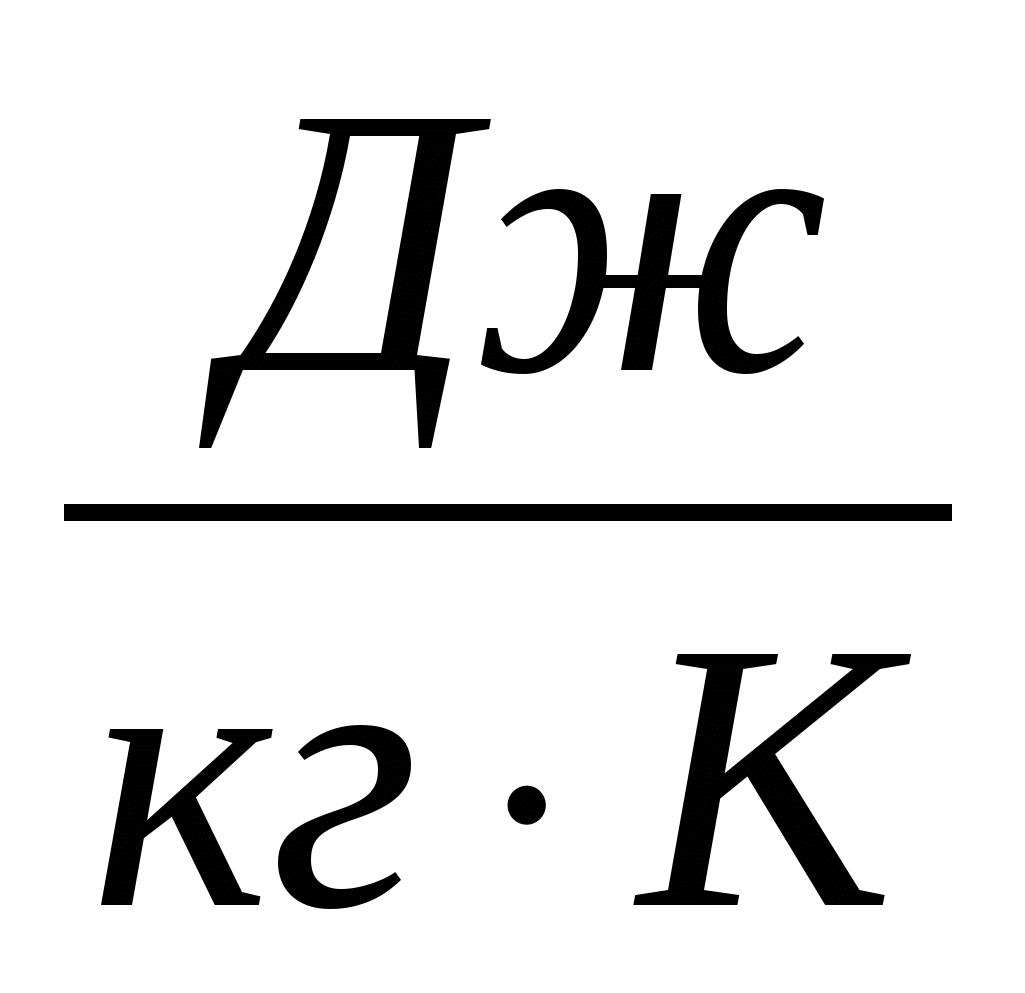 , железа 460 и стали 500.
, железа 460 и стали 500.
А.) медный; Б.) стальной; В.) железный.
2.28. Идеальный газ расширяется по закону 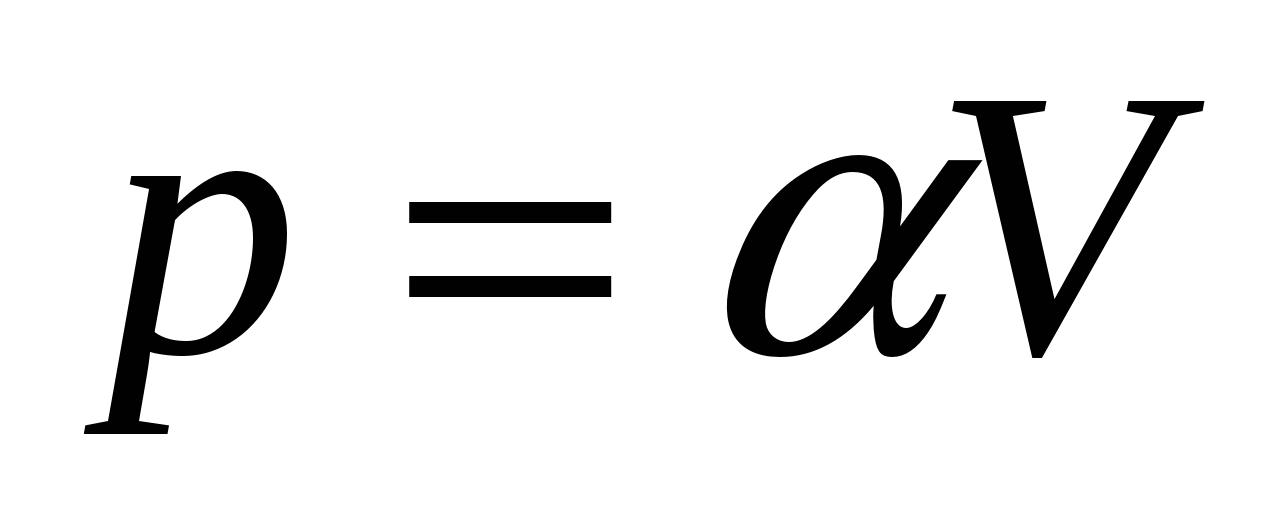 . Найдите графически работу, совершенную газом при увеличении объёма от V 1 до V 2 .
. Найдите графически работу, совершенную газом при увеличении объёма от V 1 до V 2 .
А.) 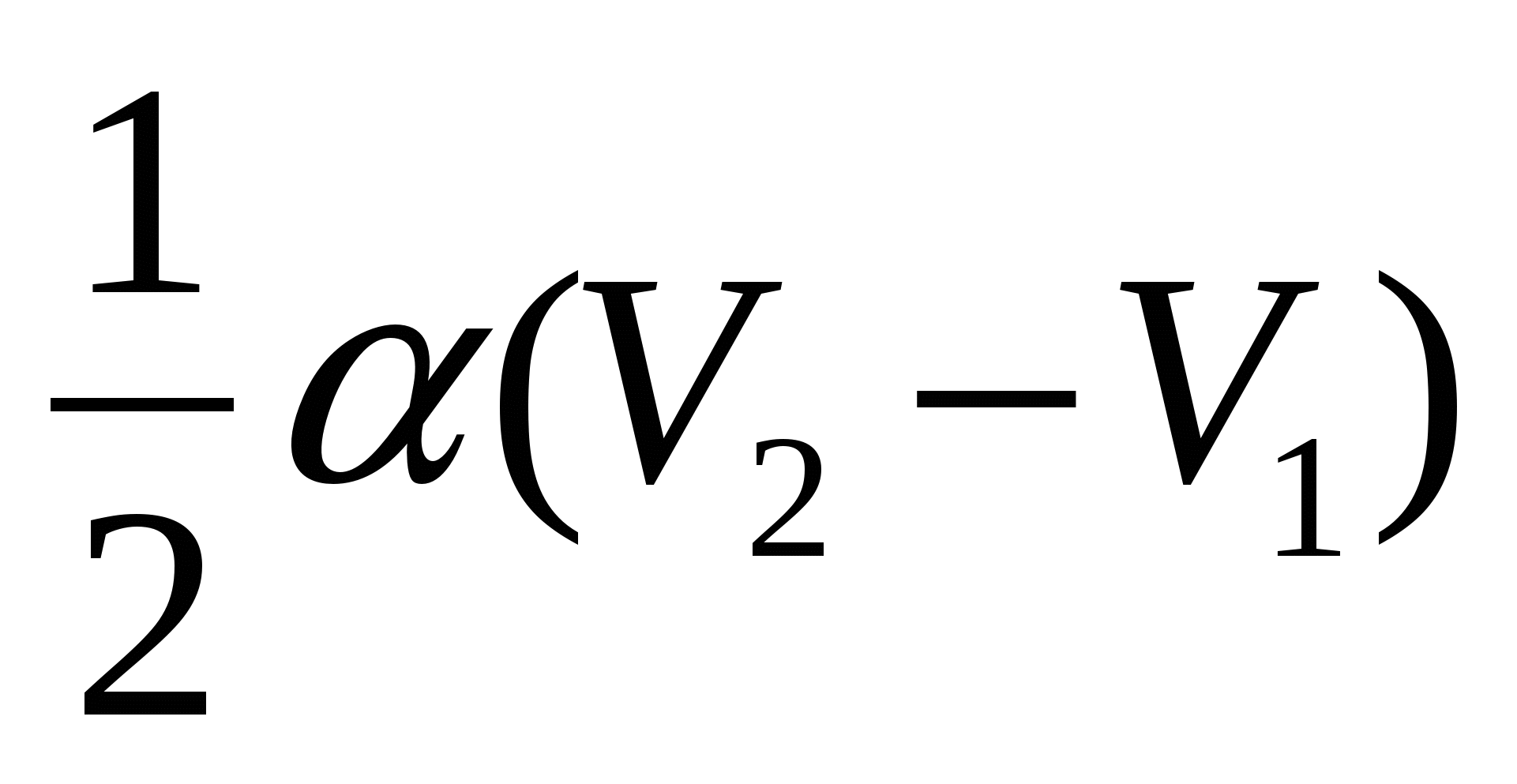 ; Б.)
; Б.) 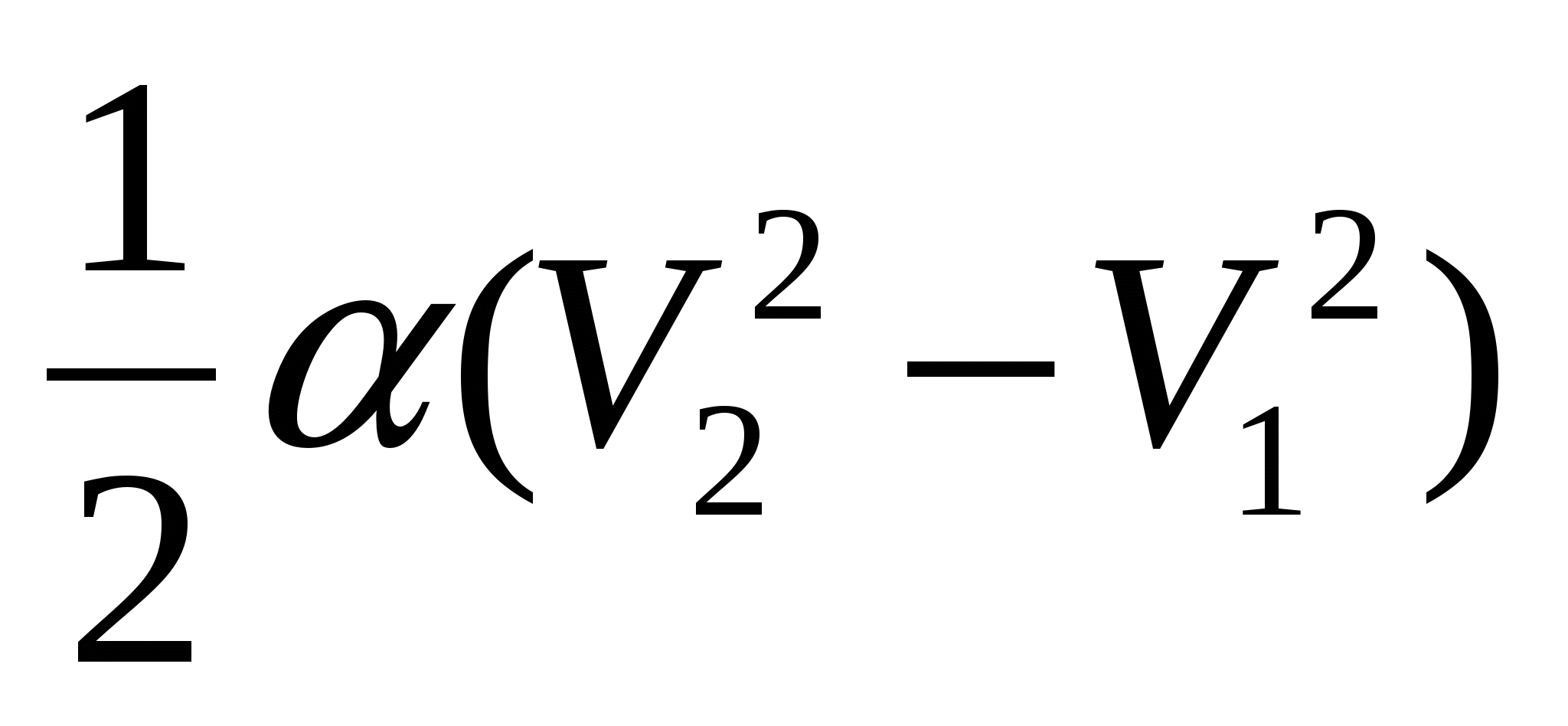 ; В.)
; В.)  .
.
2.29. В цилиндре компрессора сжимают 4 моля идеального одноатомного газа. На сколько поднялась температура газа, если была совершена работа 500 Дж? Процесс считать адиабатным.
А.) 80 К; В.) 10 К; В.) 50 К.
2.30. Газ совершает цикл Карно. 70% полученной теплоты от нагревателя отдаёт холодильнику. Температура нагревателя 430 К. Определите температуру холодильника.
А.) 3 К; Б.) 301 К; В.) 614 К.
Ключи правильных ответов
| Уровень заданий | Номера заданий и правильные ответы |
|||||||||
| 1 уровень (1 балл) | 2.01 | 2.02 | 2.03 | 2.04 | 2.05 | 2.06 | 2.07 | 2.08 | 2.09 | 2.10 |
| А | В | Б | Г | В | Г | В | В | Б | Б |
|
| 2 уровень (2 балла) | 2.11 | 2.12 | 2.13 | 2.14 | 2.15 | 2.16 | 2.17 | 2.18 | 2.19 | 2.20 |
| Д | Г | В | А | Г | Г | Г | А | В | А |
|
| 3 уровень (3 балла) | 2.21 | 2.22 | 2.23 | 2.24 | 2.25 | 2.26 | 2.27 | 2.28 | 2.29 | 2.30 |
| А | В | А | Г | Б | А | А | Б | Б | Б |
|
2.1.2 Идеальный газ. Давление и температура газа. Шкала температур
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Модель идеального газа можно использовать при изучении реальных газов, так как они в нормальных условиях, близки по своим свойствам требованиям, предъявляемым моделью идеального газа.
Действительно, совершая беспорядочные движения, молекулы газа время от времени приближаются к стенкам сосуда или к поверхности других тел на достаточно малые расстояния. Точно так же молекулы могут подойти друг к другу достаточно близко и между молекулами газа или между молекулой газа и молекулами вещества стенки возникают силы взаимодействия, которые очень быстро убывают с расстоянием. Под действием этих сил молекулы газа изменяют направление своего движения. Этот процесс (изменения направления), как известно, называется столкновением.
Столкновения молекул между собой играют очень большую роль в состоянии газа. И мы их позже детально изучим. Сейчас важно учесть столкновения молекул со стенками сосуда или с любой другой поверхностью, соприкасающейся с газом. Именно взаимодействием молекул газа и стенок определяется сила, испытываемая стенками со стороны газа, которую принято характеризовать давлением р, т. е. силой F , отнесенной к единице площади S поверхности стенки, нормальной к этой стенке:
|
p = F / S |
Свойство газа оказывать давление на стенки содержащего его сосуда - одно из основных свойств газа. Именно своим давлением газ чаще всего и обнаруживает свое присутствие. Поэтому величина давления является одной из главных характеристик газа.
Допустим, что газ заключен в сосуд, имеющий форму параллелепипеда (рисунок - 2.4), и что газ находится в состоянии равновесия. Вычислим давление газа на одну из стенок сосуда, например на правую боковую стенку abed . Направим координатную ось X вдоль ребра параллелепипеда перпендикулярно к стенке abed , как это показано на рисунке - 2.4). Как бы ни были направлены скорости v молекул, нас будут интересовать только проекции v x скоростей молекул на ось X : по направлению к стенке abed молекулы движутся именно со скоростью v x .
|
Рисунок - 2.4 |
Выделим мысленно слой газа толщиной Δх, прилегающий к выбранной стенке. На него со стороны деформированной стенки действует упругая сила F . С такой же по абсолютному значению силой и газ действует на стенку. По второму закону Ньютона импульс силы F ∆ t (где ∆ t - некоторый произвольный промежуток времени) равен изменению импульса газа в нашем слое. Но газ находится в состоянии равновесия, так что слой никакого приращения импульса в направлении импульса силы (против положительного направления оси X ) не получает. Происходит это потому, что из-за молекулярных движений выделенный слой получает импульс противоположного направления и, конечно, такой же по абсолютному значению. Его нетрудно вычислить.
При беспорядочных движениях газовых молекул за время ∆ t в наш слой слева направо входит некоторое число молекул и столько же молекул выходят из него в обратном направлении - справа налево. Входящие молекулы несут с собой определенный импульс. Выходящие из выделенного объема, молекулы несут такой же импульс противоположного знака, так что общий импульс, получаемый слоем, равен алгебраической сумме импульсов входящих в слой и выходящих из него молекул. Найдем число молекул, входящих в наш слой слева за время ∆ t .
За это время к границе a " b " c " d " слева могут подойти те молекулы, которые находятся от нее на расстоянии, не превышающем v x ∆ t . Все они находятся в объеме параллелепипеда с площадью основания S (это площадь рассматриваемой стенки) и длиной v x ∆ t , т. е. в объеме Sv x ∆ t . Если в единице объема сосуда содержится п молекул, то в указанном объеме находится nSv x ∆ t молекул. Но из них лишь половина движется слева направо и попадает в слой. Другая половина движется от него и в слой не попадает. Следовательно, за время ∆ t в слой слева направо входит 1/2 nSv ∆ t молекул. Каждая из них обладает импульсом mv x , и общий импульс, вносимый ими в слой, равен 1/2 nmv x 2 S ∆ t . За это же время слой покидает, двигаясь справа налево, такое же число молекул с таким жеобщим импульсом, но обратного знака. Таким образом, из-за прихода в слой молекул с положительным импульсом и ухода из него молекул с отрицательным импульсом общее изменение импульса слоя равно 1/2 nmv x 2 S ∆ t – (-1/2 nmv x 2 S ∆ t ) = nmv x 2 S ∆ t . Это-то изменение импульса слоя и компенсирует то изменение, которое должно было бы произойти под действием импульса силы F At . Поэтому мы можем написать: F ∆ t = nmv x 2 S ∆ t . Разделив обе части этого равенства на S ∆ t , получаем: p = F / S = nmv x 2 . До сих пор мы молча предполагали, что у всех молекул газа одинаковые проекции скорости v x . В действительности это, конечно, не так. И скорости молекул v , и их проекции v x на ось X у разных молекул, разумеется, различны. Учтем различие скоростей молекул и их проекций на оси координат тем, что заменим величину v x 2 , входящую в последнюю формулу, ее средним значением ‹v x 2 ›, так что формуле для давления газа мы придадим вид: p = nm ‹v x 2 ›. Для скорости v каждой молекулы можно написать: v 2 = v x 2 +- v 2 y + v z 2 :
|
‹v x 2 › = ‹ v x 2 ›+‹ v 2 y ›+‹ v z 2 ›. |
Из-за полной беспорядочности молекулярных движений можно полагать, что средние значения квадратов проекций скоростей на три оси координат равны друг другу, т. е., ‹ v x 2 ›= v 2 y ›=‹ v z 2 ›. А это значит, что ‹v x2 ›= v2/3. Подставив это выражение в формулу Вычислим давление газа на одну из стенок давления получаем: р = mv 2 /3 , или, умножив и разделив правую часть этого равенства на двойку, найдем
|
р =2/3 nmv 2 /2 |
Приведенные простые рассуждения справедливы для любой стенки сосуда и для любой площадки, которую мысленно можно поместить в газ. Во всех случаях мы получим для давления газа результат, выраженный последней формулой. Величина mv 2 /2 в ней представляет собой среднюю кинетическую энергию одной молекулы газа. Следовательно, давление газа равно двум третям средней кинетической энергии молекул, содержащихся в единице объема газа. Это - один из важнейших выводов кинетической теории идеального газа. Он устанавливает связь между молекулярными величинами, т. е. величинами, относящимися к отдельной молекуле, и макроскопической характеристикой газа - величиной давления, характеризующей газ как целое, - величиной, непосредственно измеряемой на опыте. Уравнение (2.9) называют основным уравнением кинетической теории идеальных газов . Важно подчеркнуть, что давление газа определяется средней кинетической энергией его молекул. Это значит, что давление газа - величина, связанная с тем, что газ состоит из большого числа молекул.
Одним из важных термодинамических параметров, характеризующих состояние газа, является температура. Температура играет важную роль не только в термодинамике, но и в физике в целом. Если тело или система тел не находится в состоянии теплового равновесия и если система изолирована (не взаимодействует с другими телами), то через некоторое время состояние теплового равновесия устанавливается само собой. Состояние теплового равновесия - это и есть состояние, в которое переходит любая изолированная система.
Одним из признаков состояния теплового равновесия и является равенство температур всех частей тела или всех тел системы. Известно, что в процессе установления теплового равновесия, т.е. при выравнивании температуры двух тел, происходит передача теплоты от одного тела другому. Следовательно, с экспериментальной точки зрения, температура тела - это величина, которая определяет, будет ли оно другому телу с иной температурой передавать теплоту или получать от него теплоту.
Этот простой опыт показывает, что температура - это величина, характеризующая состояние теплового равновесия: у тел, находящихся в состоянии теплового равновесия, температуры одинаковы. И наоборот, тела с одинаковой температурой находятся в тепловом равновесии друг с другом. А если два тела находятся в тепловом равновесии с каким-нибудь третьим телом, то оба тела находятся в тепловом равновесии и между собой. Это важное утверждение является одним из основных законов природы. Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Для измерения температуры издавна пользуются тем, что при изменении температуры тела изменяются, и его свойства. Изменяются, следовательно, величины, характеризующие эти свойства. Поэтому, для создания термометра , выбирают какое-либо вещество (термометрическое вещество ) и определенную величину, характеризующую свойство вещества (термометрическую величину ). Выбор того и другого совершенно произволен. В бытовых термометрах, например, термометрическим веществом является ртуть, а термометрической величиной - длина ртутного столбика.
Для того чтобы величине температуры можно было сопоставить определенные числовые значения, нужно еще задаться той или иной зависимостью термометрической величины от температуры. Выбор этой зависимости тоже произволен: ведь пока нет термометра, нельзя опытным путем установить эту зависимость. В случае ртутного термометра, например, избирается линейная зависимость длины ртутного столбика (объема ртути) от температуры.
Остается еще установить единицу температуры - градус (хотя в принципе ее можно было бы выражать в тех же единицах, в которых измеряется термометрическая величина, например по ртутному термометру - в сантиметрах). Величина градуса избирается тоже произвольно (как и термометрическое вещество, так и вид функции, связывающей термометрическую величину с температурой).
Размер градуса устанавливается следующим образом. Выбирают, опять-таки произвольно, две температуры (их называют реперными точками ) - обычно это температуры таяния льда и кипения воды при атмосферном давлении - и делят этот температурный интервал на некоторое (тоже произвольное) число равных частей - градусов, а одной из этих двух температур приписывают определенное числовое значение. Тем самым определяется значение второй температуры и любой промежуточной. Таким образом, получают температурную шкалу.
Современная термометрия основана на шкале идеального газа, устанавливаемой с помощью газового термометра. В принципе газовый термометр - это закрытый сосуд, наполненный идеальным газом и снабженный манометром для измерения давления газа. Термометрическим веществом в таком термометре служит идеальный газ, а термометрической величиной - давление газа при постоянном объеме. Измерение температуры производится косвенно по изменению давления газа в сосуде 1 при постоянном объеме Это позволяет принять, что отношение давлений при температурах кипения воды (р к ) и таяния льда (р 0 ) равно отношению самих этих температур: р к / р 0 = Т к / Т 0
Отношение р к / р 0 легко определить из опыта. Многочисленные измерения показали, что р к / р 0 = 1,3661. Таково, следовательно, и значение отношения температур: Т к /Т 0 = 1,3661. Размер градуса выбирается делением разности Т к - Т 0 на сто частей: Т к - Т 0 =100.
Из последних двух равенств следует, что температура таяния льда Т 0 по выбранной нами шкале равна 273,15 градусов, а температура кипения воды Т к равна 373,15 градусов. Для того чтобы при помощи газового термометра измерить температуру какого-нибудь тела, надо привести тело в контакт с газовым термометром и, дождавшись равновесия, измерить давление р газа в термометре. Тогда температура тела Т определяется по формуле
|
Т = 273,15(р/р 0 ) |
где р 0 -- давление газа в термометре, помещенном в тающий лед. Так можно получить термометрическую шкалу эмпирическим методом – эмпирическую шкалу температур . В практике газовым термометром пользуются крайне редко. На него возложена более ответственная роль - по нему градуируются все употребляемые термометры. Таким можно получить бесчисленное множество различных термометров и температурных шкал.
Создание хороших термометров и измерение температуры, особенно в широком диапазоне ее изменения,- задачи не простые. Измерить температуру какого-нибудь тела - значит сравнить ее с температурой эталона. Естественно за эталон выбрать идеальный газ, так как температура такого газа легко определяется через макропараметры, такие, как объем или давление. Причем если одна из этих величин фиксируется, то другая для данной массы газа изменяется линейно с изменением температуры Т. Чтобы температуры двух тел, исследуемого и эталонного, стали равными, необходимо привести их в тепловое равновесие.
Газовые термометры используются обычно как первичные приборы, по которым градуируют вторичные термометры, применяемые непосредственно в экспериментах. Из вторичных термометров наибольшее распространение получили жидкостные термометры, термометры сопротивления и термоэлементы.
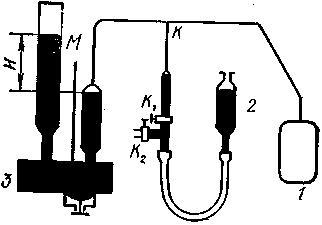
Простейшими термометрами являются жидкостные термометры, где термометрическим телом, является ртуть или этиловый спирт. Ртутный термометр представляет собой сферический или цилиндрический стеклянный резервуар, к которому припаян тонкий капилляр из стекла того же сорта. Отсчет температуры производят по шкале, прикрепленной к капилляру (рисунок - 2.5). Обычно жидкостные термометры применяются в диапазоне температур от 125 до 900 К. Нижняя граница измеряемой температуры определяется свойствами жидкости, верхняя - свойствами стекла капилляра.
На рисунке - 2.6 изображен ртутный термометр, состоящий из небольшого резервуара с ртутью, оканчивающегося тонким капилляром. При нагревании ртуть расширяется, и ее уровень h в капилляре поднимается. Шкала и начало отсчета температуры могут быть выбраны произвольно.
|
|
|
|
Рисунок - 2.5 |
Рисунок - 2.6 |
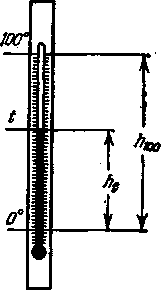
Наиболее распространенной в международной практике шкалой для измерения температуры является стоградусная шкала Цельсия. В этом случае за нуль температурной шкалы (0° С) принята температура плавления льда при нормальных условиях, т. е. при давлении р = 1 атм, а за 100°- температура кипения воды (при тех же условиях). Разделив тогда высоту капилляра h 100 между этими двумя точками на 100 равных частей, можно определить температуру t в градусах Цельсия по отношению высоты поднятия ртути в капилляре h t к интервалу между двумя постоянными точками, т. е.
Такое определение температуры пригодно лишь для грубых измерений в быту. При более точных измерениях. обнаруживается, что для разных термометрических жидкостей, например для ртутного и спиртового термометров, при одинаковой температуре численные значения отношений h 1 / h 100 - совпадают друг с другом лишь для выбранных постоянных точек. При промежуточных же температурах показания обоих термометров будут несколько расходиться, так как законы расширения различных жидкостей и сосудов, их содержащих различны.
В современной технике наиболее удобными являются электрические методы измерения температуры. В так называемых термометрах сопротивления используется изменение сопротивления металлов и полупроводников при их нагревании. Термоэлементами или термопарами измеряется электродвижущая сила, возникающая при нагревании места контакта двух металлов или полупроводников.
В термометрах сопротивления термометрическим телом является металл или полупроводник, сопротивление которого изменяется с температурой. Изменение сопротивления с температурой измеряют при помощи мостовых схем (рисунок - 2.7). Термометры сопротивления из металлов применяются в интервале температур от 70 до 1300 К, из полупроводников (термисторы) - в интервале от 150 до 400 К, а углеродистые - до температур жидкого гелия.
При любом методе определения температуры на температурной шкале можно отметить некоторую точку, имеющую абсолютное значение. Эта точка отвечает температуре, при которой отсутствует хаотическое (тепловое) движение молекул, и носит название абсолютного нуля температуры (Т = 0°С = 0°К). В случае идеального газа значению Т = 0 отвечает отсутствие кинетической энергии поступательного движения молекул и отсутствие давления. Такая шкала для измерения температуры называется абсолютной шкалой, единицей измерения служит градус Кельвина (К ). Не следует думать, что при абсолютном нуле температуры прекращается всякое движение частиц вещества. Даже если все молекулы газа остановятся, то внутри них будут двигаться электроны по определенным орбитам вокруг ядер, определенным образом будут участвовать в движении протоны и нейтроны внутри ядер. Ниже мы убедимся, что, например, средняя кинетическая энергия свободных электронов в металле при абсолютном нуле в сотни раз превышает среднюю кинетическую энергию молекул газа при комнатной температуре и т. д.