Fakta bahwa semua isobar konvergen pada satu titik (Gbr. 1.9) bukanlah kebetulan, tetapi keteraturan yang memiliki arti fisik. Hukum Gay Lussac tidak menyangkal kemungkinan kenaikan suhu yang tidak terbatas, karena volume gas dengan kenaikan suhu dapat meningkat tanpa batas. Namun demikian, dengan penurunan suhu, cenderung nol dan memiliki batas ( V = 0), karena tidak boleh negatif.
Faktanya, gas nyata bahkan tidak dapat mencapai batas ini, karena atom dan molekulnya, meskipun ukurannya kecil, masih memiliki volume tertentu.
Jika dalam persamaan (V -V 0) /V 0 =αΔ T, Menyarankan bahwa V 0 - ini adalah volume gas di t 0= 0 ° C, oleh karena itu Δ t =T -t 0 =T, dan menyamakannya dengan nol sebagai batas bawah volume, maka kita mendapatkan nilai suhu terendah pada skala Celcius yang dapat dimiliki benda:
0 = V 0. (1 + t / 273).
1 + t / 273 = 0, t = -273° C
Jadi, suhu bisa naik tanpa batas, tetapi di alam ada batas bawah - nol mutlak, di bawahnya tidak bisa turun. Inilah sebabnya mengapa isobar semua gas bertemu pada satu titik pada sumbu suhu, yaitu -273 ° C.
Tidak semua hal di dunia ini relatif; ada juga nilai absolut, khususnya suhu nol mutlak.
Adanya suhu nol mutlak dikemukakan oleh ilmuwan Inggris W. Thomson ( Kelvin) berdasarkan konstruksi skala suhu mutlak, yang tidak bergantung pada sifat-sifat benda metrik dan oleh karena itu dapat dianggap ideal. Bahan dari situs

William Thomson (Lord Kelvin) (1824 - 1907). Fisikawan Inggris, salah satu pendiri termodinamika dan teori kinetik molekuler, teori fenomena termoelektrik, fondasi osilasi elektromagnetik. Dia merumuskan hukum kedua termodinamika, memperkenalkan skala suhu absolut (skala Kelvin), menemukan efek termodinamika, memperoleh rumus untuk periode osilasi elektromagnetik alami dalam rangkaian osilasi, melakukan perhitungan ukuran molekul, dll. prestasi ilmiah menerima gelar Lord Kelvin.
Titik awal skala adalah suhu nol mutlak, nilai eksaknya adalah -273,15 ° . Satuan pengukuran adalah nilai yang disebut dalam SI kelvin(KE); ukurannya sama dengan derajat Celsius(° C): 1 K = 1 ° C. Oleh karena itu, antara suhu mutlak T dan suhu pada skala Celcius T ada hubungan sederhana (Gbr. 1.10):
T =T + 273.
Konsep suhu mutlak banyak digunakan dalam termodinamika dan fisika molekuler, karena memiliki makna fisik yang dalam dan menyederhanakan penulisan banyak persamaan.
Di halaman ini materi tentang topik:
Skala suhu termodinamika sinopsis nol mutlak
Skala suhu mutlak kuliah
Fenomena termoelektrik dan fisika molekuler
-
Suhu adalah ukuran kuantitatif dari "kehangatan" tubuh. Konsep suhu menempati tempat khusus dalam seri besaran fisika menentukan keadaan sistem. Suhu tidak hanya mencirikan keadaan kesetimbangan termal dari benda tertentu. Ini juga merupakan parameter yang mengambil nilai yang sama untuk dua atau lebih benda dalam kesetimbangan termal satu sama lain, yaitu mencirikan keseimbangan termal dari suatu sistem benda. Ini berarti bahwa jika dua atau lebih benda dengan suhu berbeda dikontakkan, maka sebagai hasil interaksi antar molekul, benda-benda tersebut akan mengambil nilai suhu yang sama.
Teori kinetik molekul memungkinkan untuk memperjelas arti fisik suhu. Membandingkan ekspresi (2.4) dan (2.7), kita melihat bahwa keduanya bertepatan jika kita menempatkan
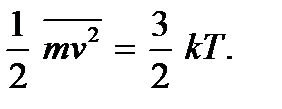 (2.9)
(2.9)Hubungan ini disebut persamaan dasar kedua dari teori kinetik molekuler gas. Mereka menunjukkan bahwa suhu mutlak ada kuantitas yang menentukan energi kinetik rata-rata dari gerakan translasi molekul; itu adalah ukuran energi gerakan translasi molekul, dan dengan demikian intensitas gerakan termal molekul. Ini adalah arti molekul-kinetik dari suhu mutlak. Seperti yang Anda lihat, proses pemanasan tubuh berhubungan langsung dengan peningkatan energi kinetik rata-rata partikel tubuh. Dari (2.9) dapat dilihat bahwa suhu mutlak bernilai positif:
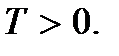 Arti
Arti 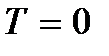 disebut suhu nol mutlak. Menurut (2.8), pada nol mutlak, gerakan translasi partikel harus benar-benar berhenti (
disebut suhu nol mutlak. Menurut (2.8), pada nol mutlak, gerakan translasi partikel harus benar-benar berhenti ( 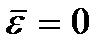 ). Namun, perlu dicatat bahwa pada suhu rendah gas berubah menjadi keadaan terkondensasi. Akibatnya, semua kesimpulan yang ditarik berdasarkan teori kinetik gas juga kehilangan maknanya. Dan pada suhu nol mutlak, gerakan tidak hilang. Pergerakan elektron dalam atom, pergerakan elektron bebas dalam logam sepenuhnya dipertahankan bahkan pada suhu nol mutlak. Selain itu, bahkan pada nol mutlak, beberapa gerakan vibrasi atom di dalam molekul dan atom di simpul kisi kristal dipertahankan. Adanya osilasi ini dikaitkan dengan adanya energi nol dalam osilator harmonik kuantum (
). Namun, perlu dicatat bahwa pada suhu rendah gas berubah menjadi keadaan terkondensasi. Akibatnya, semua kesimpulan yang ditarik berdasarkan teori kinetik gas juga kehilangan maknanya. Dan pada suhu nol mutlak, gerakan tidak hilang. Pergerakan elektron dalam atom, pergerakan elektron bebas dalam logam sepenuhnya dipertahankan bahkan pada suhu nol mutlak. Selain itu, bahkan pada nol mutlak, beberapa gerakan vibrasi atom di dalam molekul dan atom di simpul kisi kristal dipertahankan. Adanya osilasi ini dikaitkan dengan adanya energi nol dalam osilator harmonik kuantum ( 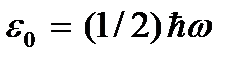 ), yang dapat dianggap sebagai getaran atom yang disebutkan di atas. Energi ini tidak bergantung pada suhu, yang berarti tidak hilang bahkan pada
), yang dapat dianggap sebagai getaran atom yang disebutkan di atas. Energi ini tidak bergantung pada suhu, yang berarti tidak hilang bahkan pada 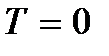 ... Pada suhu rendah, konsep klasik gerak tidak lagi terpenuhi. Di area ini, hukum kuantum beroperasi, yang menurutnya pergerakan partikel tidak berhenti, bahkan jika suhu tubuh diturunkan ke nol mutlak. Tetapi kecepatan gerakan ini tidak lagi bergantung pada suhu dan gerakan ini tidak termal. Ini dikonfirmasi oleh prinsip ketidakpastian. Jika partikel benda diam, maka posisinya (koordinat x, kamu, z) dan impuls (proyeksi impuls p x, p y, p z) akan didefinisikan secara tepat
... Pada suhu rendah, konsep klasik gerak tidak lagi terpenuhi. Di area ini, hukum kuantum beroperasi, yang menurutnya pergerakan partikel tidak berhenti, bahkan jika suhu tubuh diturunkan ke nol mutlak. Tetapi kecepatan gerakan ini tidak lagi bergantung pada suhu dan gerakan ini tidak termal. Ini dikonfirmasi oleh prinsip ketidakpastian. Jika partikel benda diam, maka posisinya (koordinat x, kamu, z) dan impuls (proyeksi impuls p x, p y, p z) akan didefinisikan secara tepat 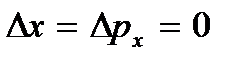 dll, dan ini bertentangan dengan hubungan ketidakpastian
dll, dan ini bertentangan dengan hubungan ketidakpastian 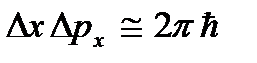 dll. Nol mutlak tidak dapat dicapai. Akan ditunjukkan di bawah ini bahwa suhu nol mutlak berarti keadaan sistem di mana sistem berada dalam keadaan dengan energi terendah, dan oleh karena itu penurunan lebih lanjut dalam intensitas gerak partikelnya karena transfer energinya ke sekitarnya tubuh tidak mungkin.
dll. Nol mutlak tidak dapat dicapai. Akan ditunjukkan di bawah ini bahwa suhu nol mutlak berarti keadaan sistem di mana sistem berada dalam keadaan dengan energi terendah, dan oleh karena itu penurunan lebih lanjut dalam intensitas gerak partikelnya karena transfer energinya ke sekitarnya tubuh tidak mungkin.Rumus (2.7) dapat ditulis sebagai.
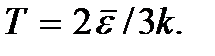
Rumus ini dapat berfungsi sebagai definisi konsep suhu absolut untuk gas monoatomik. Suhu sistem lain dapat didefinisikan sebagai nilai yang sama dengan suhu gas monoatomik dalam kesetimbangan termal dengan sistem ini. Penentuan suhu menggunakan rumus ini benar sampai suhu di mana kemungkinan munculnya keadaan tereksitasi elektronik dari atom gas tidak dapat lagi diabaikan.
Relasi (2.8) memungkinkan kita untuk memperkenalkan apa yang disebut kecepatan akar-rata-rata-kuadrat sebuah molekul, yang mendefinisikannya sebagai
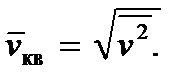
Kemudian kita mendapatkan
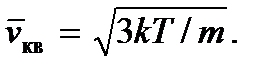
Konsep suhu absolut dapat diperkenalkan lebih ketat dalam fisika statistik, di mana ia dapat dianggap sebagai modulus distribusi energi statistik partikel. Kami juga mencatat bahwa karena suhu, serta tekanan, seperti yang dapat dilihat dari rumus (2.7) dan (2.8), ditentukan oleh energi kinetik rata-rata dari molekul gas ideal, maka toni adalah besaran statistik dan, oleh karena itu , tidak masuk akal untuk berbicara tentang suhu atau tekanan dari satu atau sejumlah kecil molekul.
Pilihan titik leleh es dan titik didih air sebagai titik utama skala suhu benar-benar sewenang-wenang. Jadi diperoleh skala suhu ternyata tidak nyaman untuk penelitian teoritis.
Berdasarkan hukum termodinamika, Kelvin berhasil membangun apa yang disebut skala suhu absolut (sekarang disebut skala suhu termodinamika atau skala Kelvin), sepenuhnya independen baik dari sifat benda termometrik atau parameter termometrik yang dipilih. Namun, prinsip membangun skala seperti itu melampaui kurikulum sekolah. Kami akan melihat masalah ini dengan menggunakan pertimbangan lain.
Dari rumus (2), dua cara yang mungkin untuk menetapkan skala suhu berikut: penggunaan perubahan tekanan sejumlah gas pada volume konstan atau perubahan volume pada tekanan konstan... Skala ini disebut skala suhu gas ideal.
Suhu yang ditentukan oleh persamaan (2) disebut suhu mutlak... Suhu mutlak? tidak boleh negatif, karena di sebelah kiri dalam persamaan (2) jelas ada nilai positif (lebih tepatnya, tidak dapat memiliki tanda yang berbeda, dapat berupa positif atau negatif. Ini tergantung pada pilihan tanda konstanta k Karena suhu titik tripel telah disepakati dianggap positif, maka suhu mutlak hanya dapat positif). Oleh karena itu, nilai suhu terkecil yang mungkin T = 0 adalah suhu ketika tekanan atau volume adalah nol.
Suhu batas di mana tekanan gas ideal menghilang pada volume tetap atau volume gas ideal cenderung nol (yaitu, gas harus, seolah-olah, dimampatkan menjadi "titik") pada tekanan konstan , disebut nol mutlak... Ini yang paling suhu rendah di alam.
Dari persamaan (3), dengan mempertimbangkan bahwa
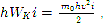
arti fisik dari nol mutlak berikut: nol mutlak adalah suhu di mana gerakan translasi termal molekul harus berhenti. Nol mutlak tidak dapat dicapai.
Sistem Satuan Internasional (SI) menggunakan skala suhu termodinamika absolut. Nol mutlak diambil sebagai suhu nol pada skala ini. Titik referensi kedua adalah suhu di mana air, es, dan uap jenuh berada dalam kesetimbangan dinamis, yang disebut titik rangkap tiga (pada skala Celcius, suhu titik rangkap adalah 0,01 ° C). Setiap satuan suhu mutlak, yang disebut Kelvin (dilambangkan dengan 1 K), sama dengan derajat Celcius.
= .Setiap pengukuran mengasumsikan titik referensi. Suhu tidak terkecuali. Untuk skala Fahrenheit, titik nol ini adalah suhu salju yang dicampur dengan garam meja, untuk skala Celsius, titik beku air. Tetapi ada titik referensi khusus untuk suhu - nol mutlak.
Suhu mutlak nol sesuai dengan 273,15 derajat Celcius di bawah nol, 459,67 derajat di bawah nol Fahrenheit. Untuk skala suhu Kelvin, suhu ini sendiri merupakan titik nol.
Inti dari suhu nol mutlak
Konsep nol mutlak berasal dari esensi suhu. Setiap tubuh memiliki energi yang diberikannya ke lingkungan eksternal selama perpindahan panas. Pada saat yang sama, suhu tubuh menurun, mis. lebih sedikit energi yang tersisa. Secara teoritis, proses ini dapat berlanjut sampai jumlah energi mencapai minimum, di mana tubuh tidak dapat lagi memberikannya.
Bayangan jauh dari gagasan semacam itu sudah dapat ditemukan di M.V. Lomonosov. Ilmuwan besar Rusia menjelaskan kehangatan dengan gerakan "rotasi". Akibatnya, tingkat pendinginan yang membatasi adalah penghentian total gerakan tersebut.Menurut konsep modern, suhu nol mutlak adalah keadaan materi di mana molekul memiliki tingkat energi serendah mungkin. Dengan energi yang lebih sedikit, mis. pada suhu yang lebih rendah, tidak ada tubuh fisik yang bisa eksis.
Teori dan praktek
Suhu nol mutlak adalah konsep teoretis, pada prinsipnya tidak mungkin untuk mencapainya dalam praktik, bahkan di laboratorium ilmiah dengan peralatan paling canggih sekalipun. Tetapi para ilmuwan berhasil mendinginkan materi ke suhu yang sangat rendah, yang mendekati nol mutlak.
Pada suhu seperti itu, zat memperoleh sifat luar biasa yang tidak dapat mereka miliki dalam keadaan normal. Merkuri, yang disebut "perak hidup" karena hampir cair, menjadi padat pada suhu ini - ke titik di mana ia dapat menggerakkan paku. Beberapa logam menjadi rapuh seperti kaca. Karet menjadi sama keras dan rapuhnya. Jika Anda memukul benda karet dengan palu pada suhu mendekati nol mutlak, benda itu akan pecah seperti kaca.
Perubahan sifat ini juga berhubungan dengan sifat kalor. Semakin tinggi suhu tubuh fisik, semakin intens dan kacau molekul bergerak. Saat suhu menurun, gerakan menjadi kurang intens, dan struktur menjadi lebih teratur. Jadi gas menjadi cair, dan cair menjadi padat. Tingkat pemesanan yang membatasi adalah struktur kristal. Pada suhu yang sangat rendah, ia diperoleh bahkan oleh zat-zat yang dalam keadaan biasa tetap amorf, misalnya, karet.
Fenomena menarik juga terjadi pada logam. Atom-atom kisi kristal bergetar dengan amplitudo yang lebih kecil, hamburan elektron berkurang, sehingga hambatan listrik berkurang. Logam memperoleh superkonduktivitas, aplikasi praktis yang tampaknya sangat menggoda, meskipun sulit untuk dicapai.
Suhu pembatas di mana volume gas ideal menjadi nol diambil sebagai suhu nol mutlak. Namun, volume gas nyata pada suhu nol mutlak tidak dapat hilang. Apakah batas suhu ini masuk akal?
Suhu pembatas, yang keberadaannya mengikuti hukum Gay-Lussac, masuk akal, karena dalam praktiknya dimungkinkan untuk membawa sifat-sifat gas nyata lebih dekat ke sifat-sifat gas ideal. Untuk melakukan ini, perlu diambil gas yang semakin dijernihkan sehingga kerapatannya cenderung nol. Dalam gas seperti itu, memang, volume dengan penurunan suhu akan cenderung membatasi, mendekati nol.
Temukan nilai nol mutlak pada skala Celcius. menyamakan volume Vv rumus (3.6.4) menjadi nol dan dengan mempertimbangkan bahwa
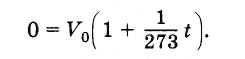
Oleh karena itu, suhu nol mutlak adalah
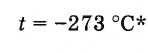
* Nilai nol mutlak yang lebih akurat: -273,15 ° .
Ini adalah suhu ekstrem, suhu terendah di alam, "derajat dingin tertinggi atau terakhir", yang keberadaannya diprediksi oleh Lomonosov.
skala kelvin

Kelvin William (Thomson W.) (1824-1907) - seorang fisikawan Inggris yang luar biasa, salah satu pendiri termodinamika dan teori kinetik molekuler gas.
Kelvin memperkenalkan skala suhu absolut dan memberikan salah satu rumusan hukum kedua termodinamika dalam bentuk ketidakmungkinan konversi panas menjadi kerja. Dia menghitung ukuran molekul berdasarkan pengukuran energi permukaan cairan. Sehubungan dengan peletakan kabel telegraf transatlantik, Kelvin mengembangkan teori osilasi elektromagnetik dan menurunkan rumus periode osilasi bebas di sirkuit. Untuk jasa ilmiah W. Thomson menerima gelar Lord Kelvin.
Ilmuwan Inggris W. Kelvin memperkenalkan skala suhu absolut. Suhu nol pada skala Kelvin sesuai dengan nol mutlak, dan satuan suhu pada skala ini sama dengan derajat Celcius, sehingga suhu mutlak T terkait dengan suhu pada skala Celcius dengan rumus
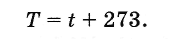 (3.7.6)
(3.7.6)Gambar 3.11 menunjukkan skala absolut dan skala Celsius untuk perbandingan.
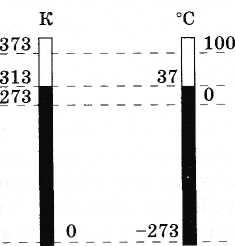
Satuan suhu mutlak dalam SI disebut kelvin (disingkat K). Oleh karena itu, satu derajat pada skala Celcius sama dengan satu derajat pada skala Kelvin: 1 ° C = 1 K.
Jadi, suhu mutlak, menurut definisi yang diberikan oleh rumus (3.7.6), adalah nilai turunan yang bergantung pada suhu Celcius dan nilai yang ditentukan secara eksperimental dari a. Namun, itu sangat penting.
Dari sudut pandang teori kinetik molekuler, suhu absolut berkaitan dengan energi kinetik rata-rata dari gerakan kacau atom atau molekul. Pada T = gerakan termal molekul berhenti. Ini dibahas secara lebih rinci dalam Bab 4.
Volume versus suhu mutlak
Menggunakan skala Kelvin, hukum Gay-Lussac (3.6.4) dapat ditulis dalam bentuk yang lebih sederhana. Karena
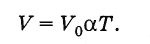 (3.7.7)
(3.7.7)Volume gas dengan massa tertentu pada tekanan konstan berbanding lurus dengan suhu mutlak.
Dari sini dapat disimpulkan bahwa rasio volume gas dengan massa yang sama di berbagai keadaan pada tekanan yang sama sama dengan rasio suhu absolut:
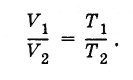 (3.7.8)
(3.7.8)Ada suhu minimum yang memungkinkan di mana volume (dan tekanan) gas ideal menghilang. Ini adalah suhu nol mutlak:-273 °C. Lebih mudah untuk membaca suhu dari nol mutlak. Ini adalah bagaimana skala suhu absolut dibangun.




