« Fizika - 10-sinf”
Qaysi gazning holati Mendeleyev-Klapeyron tenglamasi bilan tavsiflanadi.
Universal gaz konstantasini asosiy konstanta deb hisoblash mumkinmi?
Ideal gazning holat tenglamasidan foydalanib, gazning massasi va uchta parametrdan biri - bosim, hajm yoki harorat o'zgarishsiz qoladigan jarayonlarni o'rganish mumkin.
Ikki gaz parametrlari o'rtasidagi miqdoriy bog'lanishlar uchinchisining sobit qiymatida deyiladi gaz qonunlari.
Parametrlardan birining doimiy qiymati bilan davom etuvchi jarayonlar deyiladi izoprotsesslar.
"Izoprosess" so'zi murakkab so'z bo'lib, uning birinchi qismi yunoncha isos - teng, bir xil so'zdan olingan.
E'tibor bering, haqiqatda hech qanday jarayon biron bir parametrning qat'iy belgilangan qiymati bilan davom eta olmaydi. Har doim harorat, bosim yoki hajmning doimiyligini buzadigan ma'lum ta'sirlar mavjud. Faqat laboratoriya sharoitida u yoki bu parametrning doimiyligini yuqori aniqlik bilan saqlash mumkin, ammo texnik qurilmalarni ishlatishda va tabiatda bu deyarli mumkin emas. Izoprotsess - bu real jarayonning ideallashtirilgan modeli bo'lib, u faqat voqelikni taxminan aks ettiradi.
Izotermik jarayon.
Doimiy haroratda makroskopik jismlar tizimining (termodinamik tizim) holatini o'zgartirish jarayoni deyiladi. izotermik.
"Izotermik" so'zi yunoncha isos - teng, teng va therme - issiqlik so'zlaridan kelib chiqqan.
Gaz haroratini doimiy ushlab turish uchun u katta tizim - termostat bilan issiqlik almashishi kerak. Aks holda, siqish yoki kengayish vaqtida gaz harorati o'zgaradi. Atmosfera havosi, agar uning harorati butun jarayon davomida sezilarli darajada o'zgarmasa, termostat bo'lib xizmat qilishi mumkin. Ideal gazning holat tenglamasiga ko'ra (10.4), agar gazning massasi o'zgarmasa, doimiy haroratga ega bo'lgan har qanday holatda gaz bosimi va uning hajmining mahsuloti doimiy bo'lib qoladi:
pV = const da T = const. (10.6)
Bunday xulosani ingliz olimi R.Boyl (1627-1691) va birozdan keyin fransuz olimi E. Mariotte (1620-1684) tajriba asosida qilgan. Shuning uchun u o'z nomini oldi Boyl-Mapuot qonuni.
Berilgan massali gaz uchun gaz bosimi va uning hajmining mahsuloti doimiydir.
Boyl-Mariott qonuni odatda har qanday gazlar uchun, shuningdek, ularning aralashmalari uchun, masalan, havo uchun amal qiladi. Atmosfera bosimidan bir necha yuz baravar yuqori bo'lgan bosimlardagina ushbu qonundan chetlanishlar sezilarli bo'ladi.
Doimiy haroratda gaz bosimining hajmga bog'liqligini tasvirlaydigan egri chiziq deyiladi izoterm.
Gaz izotermasi bosim va hajm o'rtasidagi teskari munosabatni tasvirlaydi. Matematikada bunday egri chiziq deyiladi giperbola(10.1-rasm).
Turli xil izotermlar har xil doimiy haroratlarga mos keladi. Gaz harorati ko'tarilganda, V = const bo'lsa, (10.4) holat tenglamasi bo'yicha bosim ortadi. Shuning uchun T 2 yuqori haroratga mos keladigan izoterm pastroq harorat T 1 ga mos keladigan izotermiya ustida yotadi (10.1-rasmga qarang).
Jarayon doimiy haroratda sodir bo'lishi uchun gazning siqilishi yoki kengayishi juda sekin bo'lishi kerak. Gap shundaki, masalan, siqish paytida gaz qiziydi, chunki piston idishda harakat qilganda, pistonga zarba berishdan keyin molekulalarning tezligi va shunga mos ravishda kinetik energiyasi ortadi va natijada gaz. harorat ham ortadi. Shuning uchun izotermik jarayonni amalga oshirish uchun pistonni biroz siljitgandan so'ng, idishdagi gaz harorati yana atrofdagi havo haroratiga tenglashguncha kutish kerak.
Bunga qo'shimcha ravishda, biz tez siqilish bilan piston ostidagi bosim darhol butun idishdagidan kattaroq bo'lishini ta'kidlaymiz. Agar hajmning turli nuqtalarida bosim va harorat qiymatlari har xil bo'lsa, bu holda gaz muvozanatsiz holatda bo'ladi va biz harorat va bosim qiymatlarini nomlay olmaymiz. bu daqiqa tizim holati. Agar tizim o'z-o'zidan qoldirilsa, u holda harorat va bosim asta-sekin tenglashadi, tizim muvozanat holatiga keladi.
Muvozanat holati- bu hajmning barcha nuqtalarida harorat va bosim bir xil bo'lgan holat.
Agar gaz muvozanat holatida bo'lsa, uning holatining parametrlarini aniqlash mumkin.
Gazning barcha oraliq holatlari muvozanatda bo'ladigan jarayon deyiladi muvozanat jarayoni.
Shubhasiz, bir parametrning boshqasiga bog'liqligi grafiklarida biz faqat muvozanat jarayonlarini tasvirlashimiz mumkin.
Izobarik jarayon
Doimiy bosim ostida termodinamik tizim holatini o'zgartirish jarayoni deyiladi izobarik.
"Izobarik" so'zi yunoncha isos - teng, bir xil va baros - og'irlik, og'irlik so'zlaridan kelib chiqqan.
(10.4) tenglamaga muvofiq doimiy bosimli gazning har qanday holatida gaz hajmining uning haroratiga nisbati doimiy bo'lib qoladi:
Bu qonun 1802 yilda fransuz olimi J. Gey-Lyussak (1778-1850) tomonidan eksperimental tarzda o'rnatildi va deyiladi. Gey Lussac qonuni.
Gey Lussak qonuni:
Doimiy bosimdagi ma'lum massali gaz uchun hajmning mutlaq haroratga nisbati doimiydir.
(10.7) tenglamaga ko'ra, gazning doimiy bosimdagi hajmi haroratga proportsionaldir:
V = doimiy T. (10.8)
O'zgarmas bosimda gaz hajmining haroratga bog'liqligini tasvirlaydigan to'g'ri chiziq deyiladi izobarik.
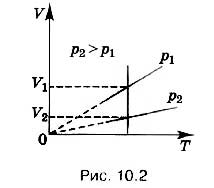
Turli xil izobarlar turli bosimlarga mos keladi (10.2-rasm). Rasmda ixtiyoriy izoterma chizamiz. Bosimning oshishi bilan gazning doimiy haroratda hajmi Boyl-Mariott qonuniga muvofiq kamayadi. Shuning uchun yuqori bosim p 2 ga mos keladigan izobar pastki bosim p 1 ga mos keladigan izobar ostida yotadi.
hududida past haroratlar barcha izobarlar ideal T = 0 nuqtasida gaz yaqinlashadi. Lekin bu hajm degani emas haqiqiy gaz yo'qoladi. Kuchli sovutish natijasida barcha gazlar suyuqlikka aylanadi va (10.4) holat tenglamasi suyuqliklarga taalluqli emas. Shuning uchun ham, ma'lum bir harorat qiymatidan boshlab, hajmning haroratga bog'liqligi chizilgan chiziq bilan chiziladi. Aslida, gaz holatidagi modda harorat va bosimning bunday qiymatlariga ega bo'lishi mumkin emas.
Izoxorik jarayon
Doimiy hajmda termodinamik tizim holatini o'zgartirish jarayoni deyiladi izoxorik.
"Izoxorik" so'zi yunoncha isos - teng, bir xil va chora - biror narsa egallagan joy, bo'shliq so'zlaridan kelib chiqqan.
(10.4) holat tenglamasidan kelib chiqadiki, doimiy hajmli gazning har qanday holatida gaz bosimining uning haroratiga nisbati doimiy bo'lib qoladi:
Bu gaz qonuni 1787 yilda frantsuz fizigi J. Sharl (1746-1823) tomonidan asos solingan va u deyiladi. Charlz qonuni.
Berilgan massali gaz uchun, agar hajm o'zgarmasa, bosimning mutlaq haroratga nisbati doimiy bo'ladi.
(10.9) tenglamaga ko'ra, doimiy hajmdagi gaz bosimi haroratga proportsionaldir:
p = doimiy T. (10.10)
O'zgarmas hajmdagi gaz bosimining haroratga bog'liqligini tasvirlaydigan to'g'ri chiziq izoxora deyiladi.
Turli xil izoxoralar turli hajmlarga mos keladi. Rasmda ixtiyoriy izotermani ham chizamiz (10.3-rasm). Doimiy haroratda gaz hajmining oshishi bilan uning bosimi Boyl-Mariot qonuniga ko'ra pasayadi. Shuning uchun kattaroq hajm V 2 ga mos keladigan izoxora kichikroq hajm V 1 ga mos keladigan izoxora ostida yotadi.
(10.10) tenglamaga muvofiq, ideal gazning barcha izoxoralari T = 0 nuqtadan boshlanadi. Demak, ideal gazning bosimi mutlaq nol nolga teng.
Har qanday idishda yoki isitish vaqtida elektr lampochkada gaz bosimining oshishi izoxorik jarayon deb hisoblanishi mumkin. Doimiy hajmli gaz termometrlarida izoxorik jarayon qo'llaniladi.
Xulosa qilib, biz mos yozuvlar sxemasini tuzamiz (10.4-rasm) va turli qonunlar va tenglamalarni bog'laydigan mantiqiy o'tishlarni ko'rsatamiz.
2. Termodinamikaning asoslari
2.01. Doimiy p bosimda gaz hajmi ∆V ga ortadi. Qanday fizik miqdor p |∆V | mahsulotga teng Ushbu holatda?
A.) gaz bilan bajariladigan ish;
B.) gazda tashqi kuchlar tomonidan bajariladigan ish;
B.) gaz qabul qilgan issiqlik miqdori;
G.) gazning ichki energiyasi.
2.02. Jismda tashqi kuchlar ta’sirida A ish bajarildi va issiqlik miqdori Q jismga o‘tdi.Jismning ichki energiyasi ∆U qanday o‘zgaradi?
A.) ∆U = A; B.) ∆U = Q B.) ∆U = A + Q; D.) ∆U = A-Q; D.) ∆U = Q-A.
2.03. Ideal gazning ichki energiyasining o'zgarishi nolga teng bo'lsa, unda qanday jarayon sodir bo'ladi?
A.) izobarik; B.) izotermik; B.) izoxorik; G.) adiabatik.
2.04. Issiqlik miqdori ideal gazga shunday o'tadiki, har qanday vaqtda Q uzatilgan issiqlik miqdori gaz bajargan A ishiga teng bo'ladi. Qanday jarayon amalga oshirilmoqda?
A.) adiabatik; B.) izobarik; B.) izoxorik; G.) izotermik.
2.05. Qanday fizik miqdor formula bo'yicha hisoblanadi?
A.) ideal gazdagi issiqlik miqdori;
B.) ideal gaz bosimi;
C.) bir atomli ideal gazning ichki energiyasi;
G.) bir mol ideal gazning ichki energiyasi.
2.06. Quyidagi formulalar orasida issiqlik dvigatelining maksimal samaradorligini hisoblaydigan formulani toping.
A.) 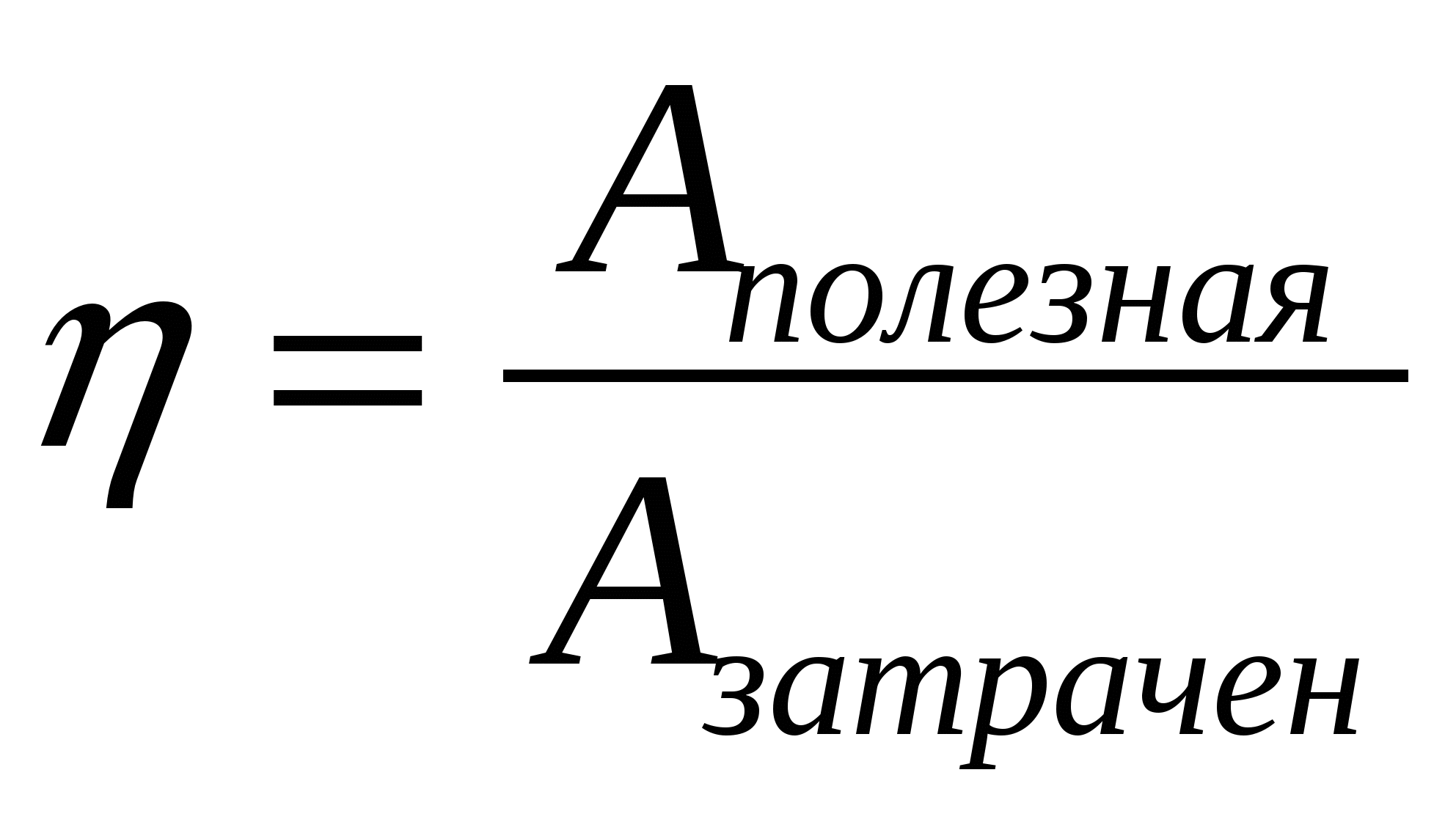 ; B.)
; B.)  ; V.)
; V.) 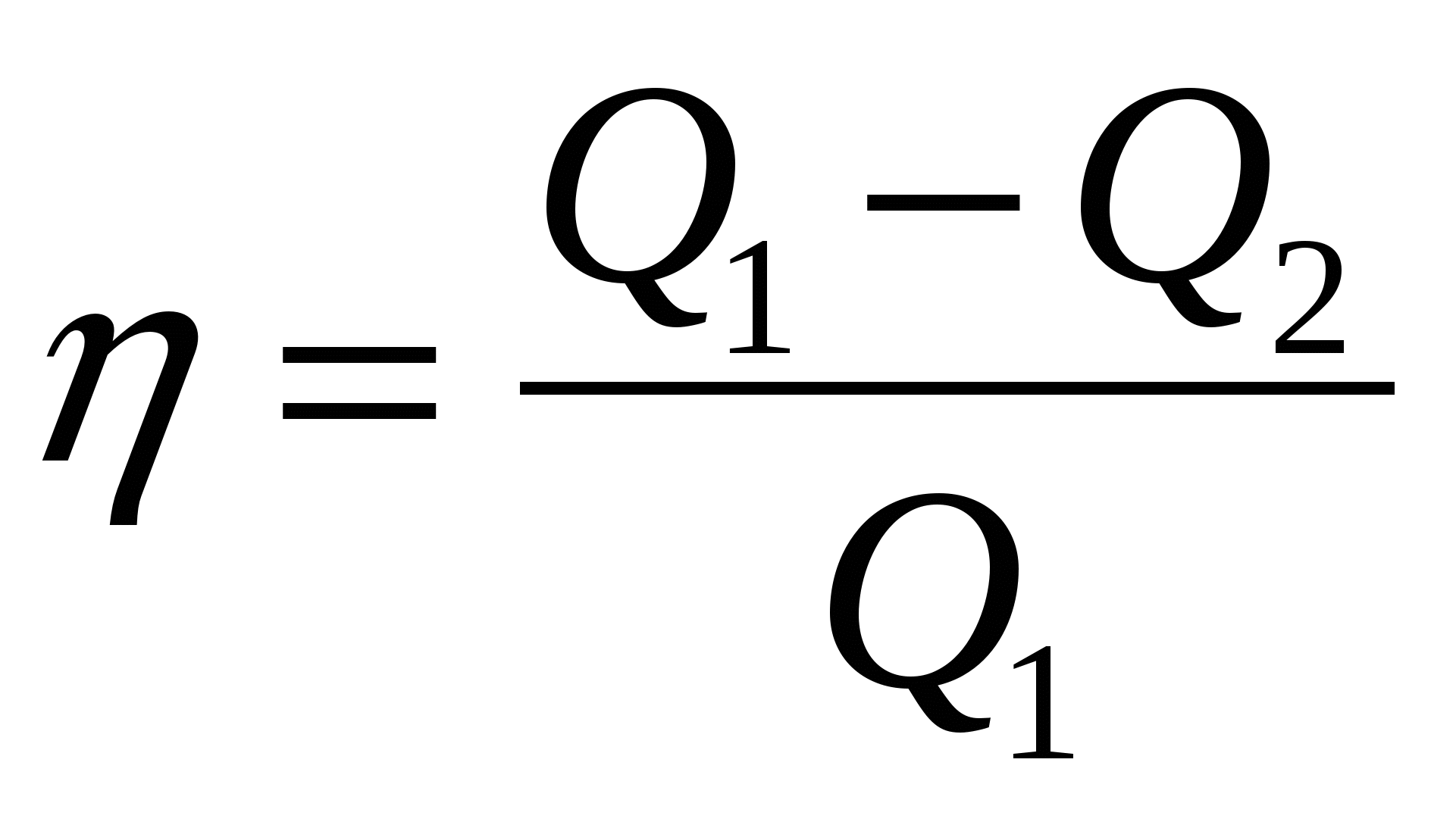 ; G.)
; G.)  .
.
2.07. Ideal gazning ichki energiyasining o'zgarishi berilgan issiqlik miqdoriga teng bo'lsa, unda qanday jarayon sodir bo'ladi?
A.) izobarik; B.) izotermik; B.) izoxorik; G.) adiabatik.
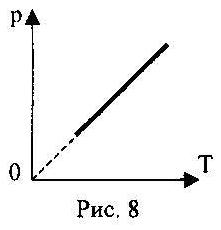 2.08. 8-rasmda ideal gazga ega bo'lgan izoprosess sxemasi ko'rsatilgan. Unga termodinamikaning birinchi qonunini yozing.
2.08. 8-rasmda ideal gazga ega bo'lgan izoprosess sxemasi ko'rsatilgan. Unga termodinamikaning birinchi qonunini yozing.
A.) ∆U = Q + A /;
B.) ∆U = A /;
2 .09. Shaklda. 9-da ma'lum bir gaz massasi uchun adiabat va izotermiya grafiklari ko'rsatilgan. Ushbu ikkita egri chiziqdan qaysi biri adiabat?
.09. Shaklda. 9-da ma'lum bir gaz massasi uchun adiabat va izotermiya grafiklari ko'rsatilgan. Ushbu ikkita egri chiziqdan qaysi biri adiabat?
A.) 1 - adiabat, 2 - izoterm;
B.) 1 - izoterma, 2 - adiaba;
B.) to'g'ri javob yo'q.
2.10. Tsilindagi gazning tez siqilishi bilan uning harorati oshdi. Bu holatda gazning ichki energiyasi o'zgaradimi? Bu holat uchun termodinamikaning birinchi qonuni tenglamasini yozing.
A.) energiya kamaydi Q = ∆U + A /;
B.) energiya oshdi ∆U = -A /;
B.) energiya o'zgarmagan Q = A /.
2.11. 300 K haroratda olingan ikki mol monoatomik (ideal) gazning ichki energiyasini aniqlang.
A.) 2,5 kJ; B.) 2,5 J; B.) 4,9 J; G.) 4,9 kJ; D.) 7,5 kJ.
2.12. T 1 = T va T 2 = 2T bo'lsa, bir mol ideal bir atomli gazning ichki energiyasi qanday o'zgaradi?
A.) RT; B.) 2RT; B.) 3RT; G.) 1,5RT.
2.13. V 1 = 0,1 m 3 hajmdan V 2 = 0,2 m 3 hajmgacha 2 ∙ 10 5 Pa bosimda izobar tarzda kengaygan gaz qanday ishni bajaradi?
A.) 2 ∙ 10 6 J; B.) 200 kJ; B.) 0,2 ∙ 10 5 J.
2.14. Termodinamik tizimga 2000 J ga teng issiqlik miqdori o'tkazildi va unda 500 J ish bajarildi. Shu sistemaning ichki energiyasining o'zgarishini aniqlang.
A.) 2500 J; B.) 1500 J; B.) ∆U = 0.
2.15. Kamerada yoqilg'ining yonishi natijasida 600 J ga teng energiya ajralib chiqdi va muzlatgich 400 J ga teng energiya oldi. Dvigatel qanday ish qildi?
A.) 1000 J; B.) 600 J; V.) 400 J; G.) 200 J.
2.16. Kislorodning ma'lum bir massasini ∆T = 160 K da izobarik isitish bilan uning hajmini oshirish uchun 8,31 J ish bajarildi. M = 3,2 ∙ 10 -2 kg / mol, R = 8,31 J / (K ∙ mol) bo'lsa, kislorodning massasini aniqlang.
A.) 0,2 kg; B.) 2 kg; B.) 0,5 kg; G.) 0,2 g.
2.17. Harorati 427 0 S bo'lgan isitgich va 27 0 S haroratli muzlatgich ishlatadigan issiqlik dvigatelining maksimal samaradorligi qanday?
A.) 40%; B.) 6%; B.) 93%; G.) 57%.
2.18. Ideal issiqlik mashinasining qizdirgichining harorati 425 K, muzlatgichning harorati esa 300 K. Dvigatel qizdirgichdan 4 ∙ 10 4 J issiqlik oladi. Dvigatelning ishchi suyuqligi tomonidan bajarilgan ishni hisoblang.
A.) 1,2 ∙ 10 4 J; B.) 13,7 ∙ 10 4 J; V.) ishni hisoblash mumkin emas.
2.19. Piston ostida tsilindrda havo bor, og'irligi 29 kg. Havoning harorati 100 K ga ko'tarilgan bo'lsa, izobarik kengayish paytida havo qanday ish qiladi. Pistonning massasini hisobga olmang.
A.) 831 J; B.) 8,31 kJ; B.) 0,83 MJ.
2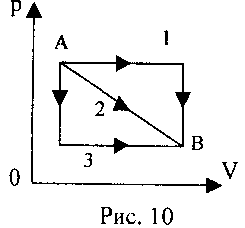 .yigirma. Ideal gaz A holatdan B holatga (10-rasmga qarang) uch xil usulda o'tadi. Qachon gaz maksimal ishlagan?
.yigirma. Ideal gaz A holatdan B holatga (10-rasmga qarang) uch xil usulda o'tadi. Qachon gaz maksimal ishlagan?
2.21. Muz bo'lagi 1 K ga qizdirilsa, qaysi balandlikdan qulagan? O'ylab ko'ring, uning potentsial energiyasining 60% muz bo'lagini isitish uchun sarflanadi.
A.) 350 m; B.) 700 M; B.) 210 m.
2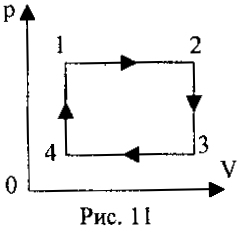 .22. Shaklda. 11 ideal gazning ma'lum bir massasining aylana jarayonini tasvirlaydi. Gaz qaysi bosqichlarda issiqlik olganligini ko'rsating.
.22. Shaklda. 11 ideal gazning ma'lum bir massasining aylana jarayonini tasvirlaydi. Gaz qaysi bosqichlarda issiqlik olganligini ko'rsating.
A.) 1-2 va 2-3;
B.) 3-4 va 4-1;
B.) 1-2 va 4-1;
G.) 2-3 va 3-4.
2.23. 1 mol miqdoridagi gaz 2 ta izoxora va 2 izobardan iborat bo'lgan tsiklni hosil qiladi. Gazning eng kichik hajmi 10 litr, eng kattasi 20 litr. Eng past bosim 2,5 atm, eng yuqori - 5 atm. Har bir tsikl uchun ishni toping.
A.) 2,5 kJ; B.) 5 kJ; B.) 100 kJ; G.) 2,5 J.
2.24. 20 litr hajmli yopiq idishda normal sharoitda bo'lgan neon 91 K ga sovutildi. Gazning ichki energiyasi va unga berilgan issiqlik miqdori o'zgarishini toping.
A.) 1 MJ; B.) 0,6 kJ; B.) 1,5 kJ; G.) 1 kJ.
2.25. Gaz Karno siklini yakunlaydi. Isitgichning mutlaq harorati 3 barobar yuqori mutlaq harorat muzlatgich. Sovutgichga berilgan issiqlik ulushini aniqlang.
A.) 1/2; B.) 1/3; B.) 1/5; G.) 2/3.
2.26. Gaz Karno siklini yakunlaydi. Isitgichning harorati T 1 = 380 K, muzlatgich T 2 = 280 K. Isitgichning harorati ∆T = 200 K ga oshirilsa, tsiklning samaradorligi necha marta oshadi.
A.) 2 marta; B.) 3 marta; B.) 1,5 martaga; G.) 2,5 marta.
2.27. Massasi bir xil bo'lgan uchta to'p - mis, po'lat va temir - bir xil balandlikdan plitkali polga tushadi. Qaysi biri ko'proq qiziydi yuqori harorat... Misning solishtirma issiqligi 400 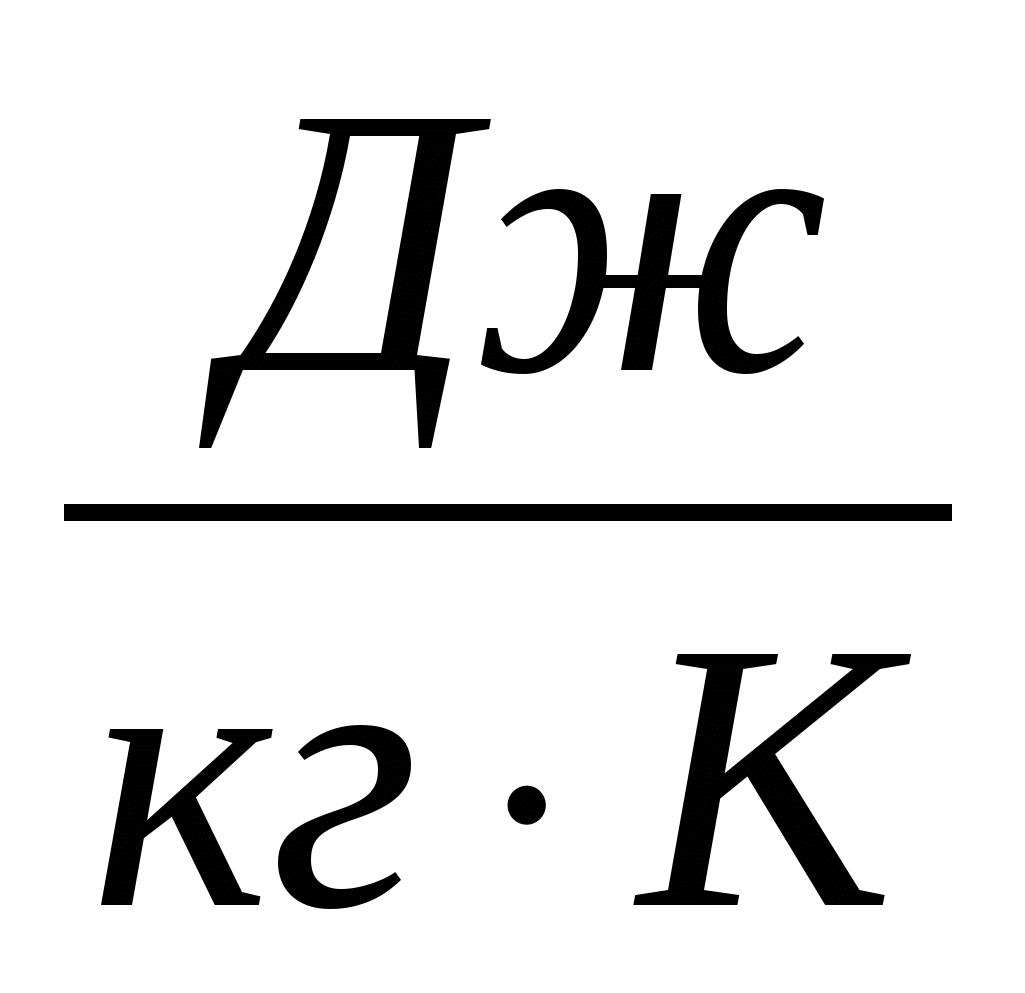 , temir 460 va po'lat 500.
, temir 460 va po'lat 500.
A.) mis; B.) po'lat; V.) temir.
2.28. Ideal gaz qonun bilan kengayadi 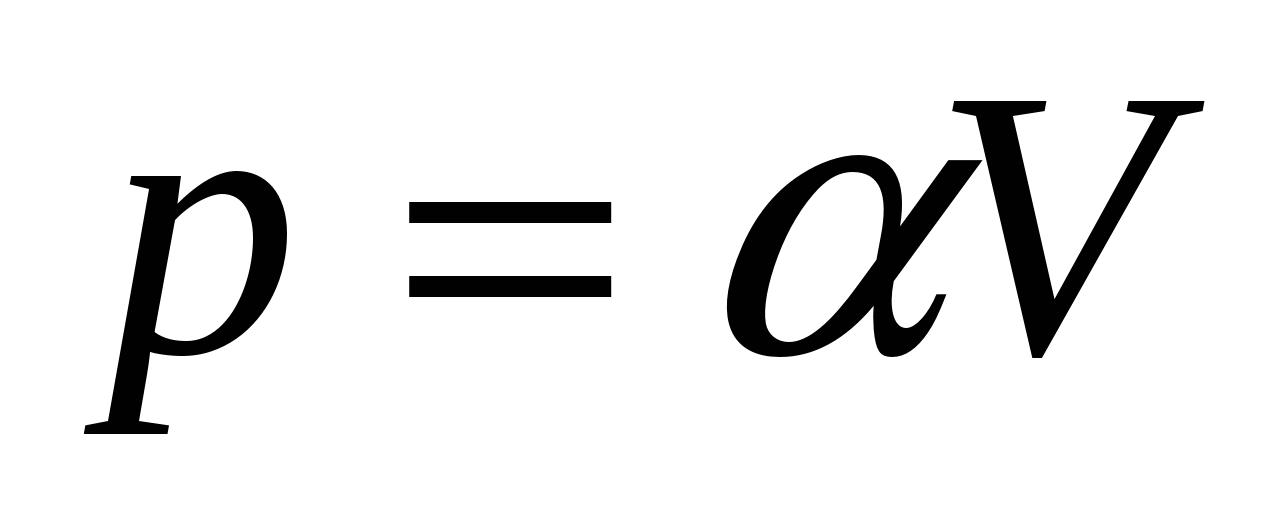 ... Hajmi V 1 dan V 2 gacha ortishi bilan gaz bajargan ishni grafik tarzda toping.
... Hajmi V 1 dan V 2 gacha ortishi bilan gaz bajargan ishni grafik tarzda toping.
A.) 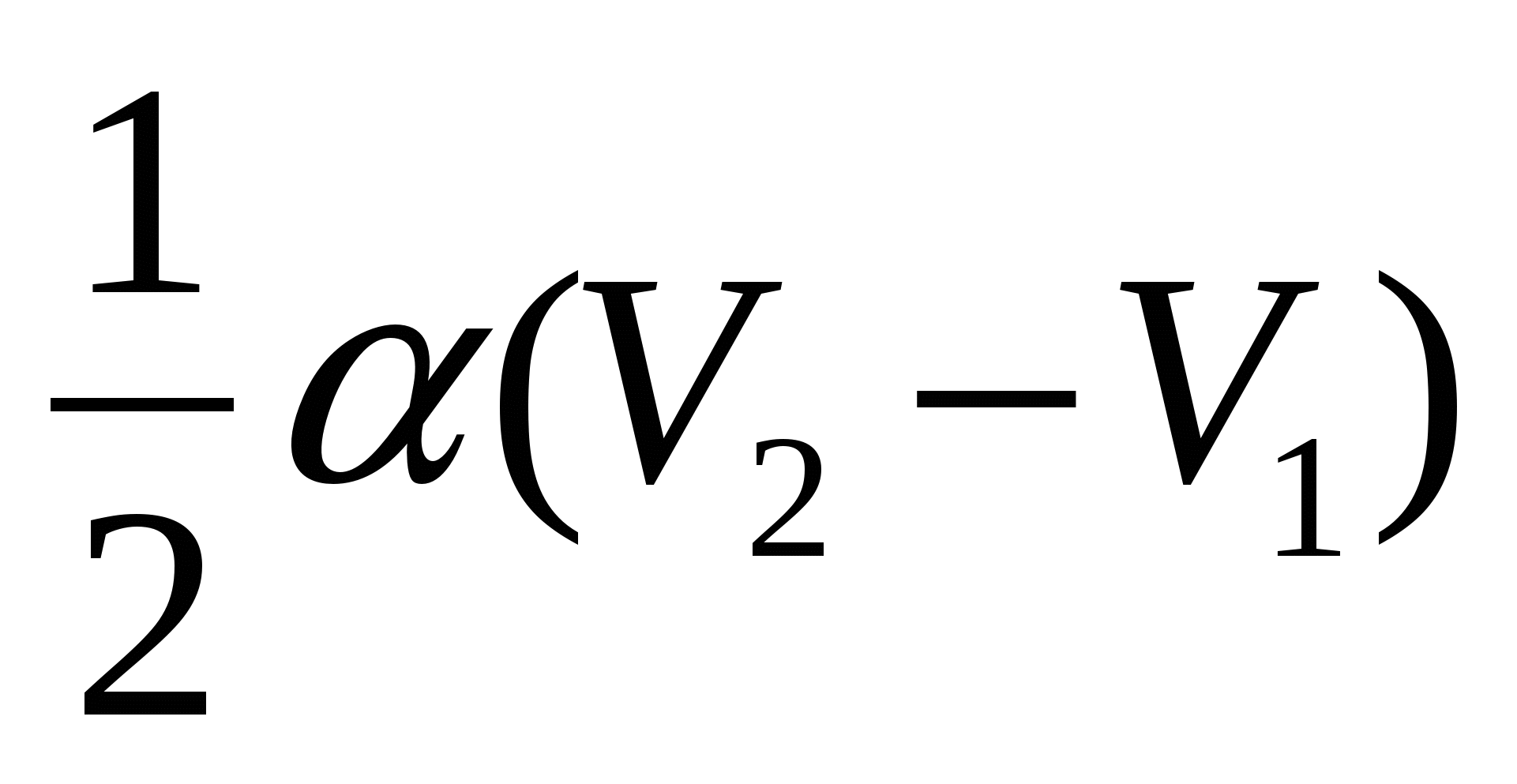 ; B.)
; B.) 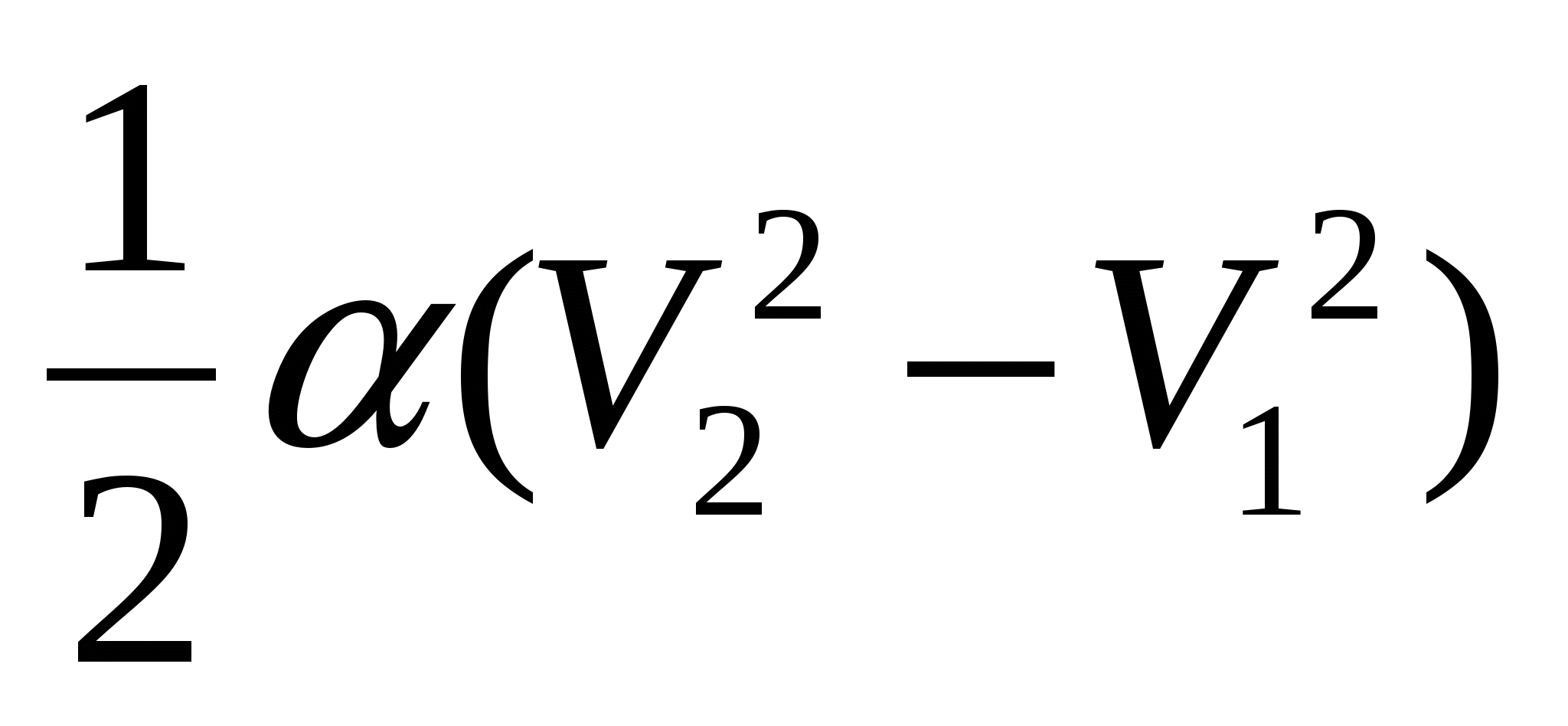 ; V.)
; V.)  .
.
2.29. Kompressor tsilindrida 4 mol ideal monoatomik gaz siqiladi. Agar ish 500 J bajarilgan bo'lsa, gaz harorati qancha ko'tarilgan? Jarayon adiabatik deb hisoblanadi.
A.) 80 K; B.) 10 K; C.) 50 K.
2.30. Gaz Karno siklini yakunlaydi. Isitgichdan olingan issiqlikning 70% muzlatgichga qaytariladi. Isitgich harorati 430 K. Sovutgich haroratini aniqlang.
A.) 3 K; B.) 301 K; B.) 614 K.
To'g'ri javoblar kalitlari
| Kvest darajasi | Vazifa raqamlari va to'g'ri javoblar |
|||||||||
| 1-darajali (1 ball) | 2.01 | 2.02 | 2.03 | 2.04 | 2.05 | 2.06 | 2.07 | 2.08 | 2.09 | 2.10 |
| A | V | B | G | V | G | V | V | B | B |
|
| 2-darajali (2 ball) | 2.11 | 2.12 | 2.13 | 2.14 | 2.15 | 2.16 | 2.17 | 2.18 | 2.19 | 2.20 |
| D | G | V | A | G | G | G | A | V | A |
|
| 3-daraja (3 ball) | 2.21 | 2.22 | 2.23 | 2.24 | 2.25 | 2.26 | 2.27 | 2.28 | 2.29 | 2.30 |
| A | V | A | G | B | A | A | B | B | B |
|
2.1.2 Ideal gaz. Gaz bosimi va harorati. Harorat shkalasi
Molekulyar kinetik nazariyadan foydalaniladi ideallashtirilgan modelideal gaz, unga ko'ra:
1) gaz molekulalarining ichki hajmi idish hajmiga nisbatan ahamiyatsiz;
2) gaz molekulalari o'rtasida o'zaro ta'sir kuchlari mavjud emas;
3) gaz molekulalarining bir-biri bilan va idish devorlari bilan to'qnashuvi mutlaqo elastikdir. Haqiqiy gazlarni o'rganish uchun ideal gaz modelidan foydalanish mumkin, chunki normal sharoitda ular o'z xususiyatlariga ko'ra ideal gaz modeli talablariga o'xshashdir.
Darhaqiqat, tasodifiy harakatlarni amalga oshirib, gaz molekulalari vaqti-vaqti bilan idishning devorlariga yoki boshqa jismlarning yuzasiga juda kichik masofada yaqinlashadi. Xuddi shu tarzda, molekulalar bir-biriga etarlicha yaqinlashishi mumkin va gaz molekulalari o'rtasida yoki gaz molekulasi va devor moddasi molekulalari o'rtasida o'zaro ta'sir kuchlari paydo bo'ladi, ular masofa bilan juda tez kamayadi. Ushbu kuchlar ta'sirida gaz molekulalari harakat yo'nalishini o'zgartiradi. Bu jarayon (yo'nalishni o'zgartirish), siz bilganingizdek, deyiladi to'qnashuv.
Gaz holatida molekulalarning bir-biri bilan to'qnashuvi juda muhim rol o'ynaydi. Va biz ularni keyinroq batafsil o'rganamiz. Endi molekulalarning tomir devorlari yoki gaz bilan aloqa qiladigan boshqa sirt bilan to'qnashuvini hisobga olish muhimdir. Bu gaz molekulalari va devorlarning o'zaro ta'siri bo'lib, bu odatda gaz tomondan devorlarga ta'sir qiladigan kuchni belgilaydi. bosimR, ya'ni kuch bilan F, maydon birligi uchun S Ushbu devorga normal devor yuzasi:
|
p = F/ S |
Gazni o'z ichiga olgan idishning devorlariga bosim o'tkazish xususiyati gazning asosiy xususiyatlaridan biridir. Gaz ko'pincha uning mavjudligini o'z bosimi orqali ochib beradi. Shuning uchun bosim qiymati gazning asosiy xususiyatlaridan biridir.
Faraz qilaylik, gaz parallelepiped shaklidagi idishga o'ralgan (2.4-rasm) va gaz muvozanatda bo'lsin. Idishning devorlaridan birida, masalan, o'ng yon devorda gaz bosimini hisoblaylik Yotoq. Keling, koordinata o'qini yo'naltiramiz X devorga perpendikulyar parallelepipedning chekkasi bo'ylab Yotoq, rasmda ko'rsatilganidek - 2.4). Tezliklar qanday yo'naltirilganligidan qat'i nazar v molekulalar, biz faqat proektsiyalar bilan qiziqamiz v x eksa bo'yicha molekulyar tezliklar X: devor tomon Yotoq molekulalar aynan tezlikda harakat qiladi v x .
|
Shakl - 2.4 |
Keling, qalinligi bo'lgan gaz qatlamini aqliy ravishda tanlaylik Dx, tanlangan devorga ulashgan. Deformatsiyalangan devor tomondan unga elastik kuch ta'sir qiladi F. Gaz devorga mutlaq qiymatda bir xil kuch bilan ta'sir qiladi. Nyutonning ikkinchi qonuniga ko'ra, kuch impulsi F∆ t (qaerda ∆ t - ba'zi ixtiyoriy vaqt oralig'i) bizning qatlamimizdagi gaz impulsining o'zgarishiga teng. Ammo gaz muvozanat holatidadir, shuning uchun qatlam kuch impulsi yo'nalishi bo'yicha (o'qning ijobiy yo'nalishiga qarshi) impulsning o'sishiga ega bo'lmaydi. X) olmang. Buning sababi, molekulyar harakatlar tufayli tanlangan qatlam teskari yo'nalishda impuls oladi va, albatta, mutlaq qiymatda bir xil. Uni hisoblash qiyin emas.
Bir muddat gaz molekulalarining tasodifiy harakatlarida ∆ t ma'lum miqdordagi molekulalar bizning qatlamimizga chapdan o'ngga kiradi va bir xil miqdordagi molekulalar uni tark etadi. teskari yo'nalish- o'ngdan chapga. Kiruvchi molekulalar o'zlari bilan ma'lum bir impulsni olib yuradilar. Tanlangan hajmdan chiqib ketayotgan molekulalar bir xil qarama-qarshi belgili impulsni olib yuradi, shuning uchun qatlam tomonidan qabul qilingan umumiy impuls qatlamga kirish va undan chiqadigan molekulalar momentlarining algebraik yig‘indisiga teng bo‘ladi. Qatlamimizga vaqt ichida chap tomondan kirgan molekulalar sonini topamiz ∆ t.
Shu vaqt ichida chegaraga a" b" c" d" chapga, undan ko'p bo'lmagan masofada joylashgan molekulalar v x ∆ t. Ularning barchasi asos maydoniga ega parallelepiped hajmida S(bu ko'rib chiqilayotgan devorning maydoni) va uzunligi v x ∆ t, ya'ni hajmda Sv x ∆ t. Idishning hajm birligi o'z ichiga olgan bo'lsa P molekulalar, keyin ko'rsatilgan hajmda mavjud nSv x ∆ t molekulalar. Ammo ularning faqat yarmi chapdan o'ngga siljiydi va qatlamga tushadi. Ikkinchi yarmi undan uzoqlashadi va qatlamga kirmaydi. Shuning uchun, vaqt davomida ∆ t chapdan o'ngga qatlamda kiradi 1/2 nSv∆ t molekulalar. Ularning har biri impulsga ega mv x, va ular tomonidan qatlamga kiritilgan umumiy impuls teng 1/2 nmv x 2 S ∆ t. Shu bilan birga, qatlam o'ngdan chapga siljiydi. , bir xil umumiy impulsli, ammo teskari belgiga ega bo'lgan molekulalar soni bir xil. Shunday qilib, qatlamga ijobiy impulsli molekulalarning kelishi va undan manfiy impulsli molekulalarning ketishi tufayli qatlam impulsining umumiy o'zgarishi. 1/2 nmv x 2 S ∆ t – (-1/2 nmv x 2 S ∆ t) = nmv x 2 S ∆ t. Kuch impulsi ta'sirida sodir bo'lishi kerak bo'lgan o'zgarishni qoplaydigan qatlam impulsining o'zgarishi. F Da. Shunday qilib, biz yozishimiz mumkin: F ∆ t = nmv x 2 S ∆ t. Ushbu tenglikning ikkala tomonini S ga bo'lish ∆ t, olamiz: p = F/ S = nmv x 2 . Shu paytgacha biz barcha gaz molekulalari bir xil tezlik proyeksiyasiga ega deb jimgina taxmin qilgan edik. v x . Aslida, bu, albatta, bunday emas. Va molekulalarning tezligi v, va ularning prognozlari v x eksa bo'yicha X turli molekulalar, albatta, har xil. Qiymatni almashtirib, molekulalarning tezligi va ularning koordinata o'qlaridagi proyeksiyalaridagi farqni hisobga olaylik. v x 2 , oxirgi formulaga kiritilgan, uning o'rtacha qiymat ‹ v x 2 ›, shuning uchun gaz bosimi formulasini quyidagi shaklda beramiz: p = nm‹ v x 2 ›. Tezlik uchun v Har bir molekula yozilishi mumkin: v 2 = v x 2 +- v 2 y + v z 2 :
|
‹ v x 2 › = ‹ v x 2 ›+‹ v 2 y ›+‹ v z 2 ›. |
Molekulyar harakatlarning to'liq buzilishi tufayli, uchta koordinata o'qi bo'yicha tezlik proyeksiyalari kvadratlarining o'rtacha qiymatlari bir-biriga teng deb taxmin qilish mumkin, ya'ni. ‹ v x 2 ›= v 2 y ›=‹ v z 2 ›. Bu shuni anglatadiki ‹ v x2 ›= v2 / 3. Ushbu ifodani formulaga almashtirib, bosim devorlarining birida gaz bosimini hisoblaymiz: p = mv 2 /3 , yoki, bu tenglikning o'ng tomonini ikkiga ko'paytirib, bo'lib, topamiz
|
p = 2/3nmv 2 /2 |
Yuqoridagi oddiy mulohaza har qanday tomir devori va gazga aqliy ravishda joylashtirilishi mumkin bo'lgan har qanday maydon uchun amal qiladi. Barcha holatlarda biz oxirgi formula bilan ifodalangan gaz bosimi uchun natijani olamiz. Kattaligi mv 2 /2 u bitta gaz molekulasining o'rtacha kinetik energiyasini ifodalaydi. Demak, gaz bosimi gazning birlik hajmidagi molekulalarning o'rtacha kinetik energiyasining uchdan ikki qismiga teng. Bu ideal gazning kinetik nazariyasining eng muhim xulosalaridan biridir. U molekulyar miqdorlar, ya'ni alohida molekulaga tegishli miqdorlar va gazning makroskopik xarakteristikasi - gazni bir butun sifatida tavsiflovchi bosim qiymati - bevosita eksperimental o'lchanadigan miqdor o'rtasidagi bog'liqlikni o'rnatadi. Tenglama (2.9) deyiladi ideal gazlar kinetik nazariyasining asosiy tenglamasi... Gaz bosimining o'rtacha bilan aniqlanishini ta'kidlash muhimdir uning molekulalarining kinetik energiyasi. Bu shuni anglatadiki, gaz bosimi gazning ko'p miqdordagi molekulalardan iboratligi bilan bog'liq bo'lgan miqdordir.
Gaz holatini tavsiflovchi muhim termodinamik parametrlardan biri bu haroratdir. Harorat nafaqat termodinamikada, balki umuman fizikada ham muhim rol o'ynaydi. Agar tana yoki jismlar tizimi issiqlik muvozanat holatida bo'lmasa va tizim izolyatsiya qilingan bo'lsa (boshqa jismlar bilan o'zaro ta'sir qilmasa), u holda bir muncha vaqt o'tgach, issiqlik muvozanat holati o'z-o'zidan o'rnatiladi. Issiqlik muvozanatining holati - har qanday izolyatsiya qilingan tizim o'tadigan holat.
Issiqlik muvozanat holatining belgilaridan biri tananing barcha qismlari yoki tizimning barcha jismlari haroratining tengligidir. Ma'lumki, issiqlik muvozanatini o'rnatish jarayonida, ya'ni. ikki jismning harorati tenglashtirilganda issiqlik bir jismdan ikkinchisiga o'tadi. Shuning uchun, tajriba nuqtai nazaridan, tananing harorati boshqa haroratga ega bo'lgan boshqa jismga issiqlik o'tkazish yoki undan issiqlik olishini aniqlaydigan miqdordir.
Bu oddiy tajriba shuni ko'rsatadiki, harorat termal muvozanat holatini tavsiflovchi kattalikdir: issiqlik muvozanati holatidagi jismlar bir xil haroratga ega. Aksincha, bir xil haroratga ega bo'lgan jismlar bir-biri bilan termal muvozanatda bo'ladi. Va agar ikkita jism uchinchi jism bilan termal muvozanatda bo'lsa, ikkala jism ham bir-biri bilan issiqlik muvozanatida bo'ladi. Bu muhim bayonot tabiatning asosiy qonunlaridan biridir. Harorat- makroskopik tizimning termodinamik muvozanat holatini tavsiflovchi fizik miqdor.
Haroratni o'lchash uchun ular uzoq vaqt davomida tananing harorati o'zgarganda uning xususiyatlari ham o'zgarishi faktidan foydalanganlar. Natijada, ushbu xususiyatlarni tavsiflovchi qiymatlar o'zgaradi. Shuning uchun, yaratish uchun termometr, har qanday moddani tanlang (termometrik modda) va moddaning xususiyatini tavsiflovchi ma'lum bir qiymat (termometrik qiymat). Ikkalasini tanlash butunlay o'zboshimchalik bilan amalga oshiriladi. Uy termometrlarida, masalan, termometrik modda simob, termometrik qiymat esa simob ustunining uzunligi.
Harorat qiymatini ma'lum raqamli qiymatlar bilan solishtirish uchun, shuningdek, termometrik qiymatning haroratga u yoki bu bog'liqligini belgilash kerak. Bu bog'liqlikni tanlash ham o'zboshimchalik bilan amalga oshiriladi: termometr yo'q ekan, bu bog'liqlikni eksperimental ravishda o'rnatish mumkin emas. Simob termometrida, masalan, simob ustuni uzunligining (simob hajmi) haroratga chiziqli bog'liqligi tanlanadi.
Harorat birligini - darajani o'rnatish qoladi (garchi printsipial jihatdan u termometrik qiymat o'lchanadigan birliklarda, masalan, simob termometrida - santimetrda ifodalanishi mumkin). Darajaning kattaligi ham o'zboshimchalik bilan tanlanadi (termometrik modda ham, termometrik qiymatni harorat bilan bog'laydigan funktsiya shakli ham).
Darajaning o'lchami quyidagicha o'rnatiladi. Yana o'zboshimchalik bilan ikkita haroratni tanlang (ular deyiladi mos yozuvlar nuqtalari) - odatda bu muzning erishi va qaynoq suv harorati atmosfera bosimi- va bu harorat oralig'ini ma'lum (shuningdek, o'zboshimchalik bilan) teng qismlarga - darajalarga bo'ling va bu ikki haroratdan biriga ma'lum bir raqamli qiymat beriladi. Bu ikkinchi harorat va har qanday oraliq haroratning qiymatini aniqlaydi. Shunday qilib, bir kishi oladi harorat shkalasi.
Zamonaviy termometriyaga asoslanadi ideal gaz shkalasi, bilan o'rnatilgan gaz termometri. Asos sifatida, gaz termometri ideal gaz bilan to'ldirilgan va gaz bosimini o'lchash uchun bosim o'lchagich bilan jihozlangan yopiq idishdir. Bunday termometrdagi termometrik modda ideal gazdir, termometrik qiymat esa doimiy hajmdagi gaz bosimidir. Harorat bilvosita idishdagi gaz bosimining o'zgarishi bilan o'lchanadi. 1 doimiy hajmda Bu bizga suvning qaynash nuqtalarida bosim nisbati ( R Kimga) va muzning erishi (R 0 ) bu haroratlarning nisbatiga teng: R Kimga / R 0 = T Kimga / T 0
Munosabat R Kimga / R 0 tajribadan aniqlash oson. Ko'p o'lchovlar buni ko'rsatdi R Kimga / R 0 = 1,3661. Shunday qilib, harorat nisbati ma'nosi: T Kimga /T 0 = 1.3661. Darajaning o'lchami farqni bo'lish yo'li bilan tanlanadi T Kimga - T 0 yuz qismga: T Kimga - T 0 =100.
Oxirgi ikkita tenglikdan muzning erish harorati kelib chiqadi T 0 biz tanlagan shkala bo'yicha 273,15 daraja va suvning qaynash nuqtasi T Kimga 373,15 darajaga teng. Tananing haroratini gaz termometri bilan o'lchash uchun tanani gaz termometri bilan aloqa qilish va muvozanatni kutgandan so'ng bosimni o'lchash kerak. R termometrdagi gaz. Keyin tana harorati T formula bilan aniqlanadi
|
T = 273,15(p / p 0 ) |
qayerda R 0 -- erigan muzga joylashtirilgan termometrdagi gaz bosimi. Shunday qilib, siz termometrik shkalani empirik usul bilan olishingiz mumkin - empirik harorat shkalasi. Amalda gaz termometri kamdan-kam qo'llaniladi. Unga yanada mas'uliyatli rol yuklangan - barcha ishlatilgan termometrlar unga muvofiq sozlangan. Shu tarzda son-sanoqsiz turli xil termometrlar va harorat shkalalarini olish mumkin.
Yaxshi termometrlarni yaratish va haroratni o'lchash, ayniqsa haroratning keng diapazonida, oson ish emas. Tananing haroratini o'lchash uni standart harorat bilan solishtirishni anglatadi. Standart uchun ideal gazni tanlash tabiiydir, chunki bunday gazning harorati makroparametrlar, masalan, hajm yoki bosim orqali osongina aniqlanadi. Bundan tashqari, agar bu miqdorlardan biri o'zgarmas bo'lsa, u holda gazning ma'lum bir massasi uchun ikkinchisi haroratning o'zgarishi bilan chiziqli ravishda o'zgaradi. T. Ikki jismning o'rganilgan va mos keladigan haroratlari teng bo'lishi uchun ularni issiqlik muvozanatiga keltirish kerak.
Gaz termometrlari odatda asosiy asboblar sifatida ishlatiladi, ular bevosita tajribalarda ishlatiladigan ikkilamchi termometrlarni kalibrlash uchun ishlatiladi. Eng ko'p ishlatiladigan ikkilamchi termometrlar suyuq termometrlar, qarshilik termometrlari va termoelementlardir.
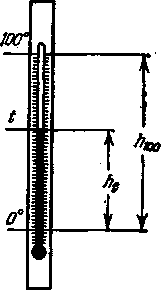
Eng oddiy termometrlar suyuq termometrlar bo'lib, bu erda termometrik tanasi simob yoki etil spirtidir. Simob termometri sharsimon yoki silindrsimon shisha rezervuar bo'lib, unga bir xil turdagi shishadan yasalgan ingichka kapillyar lehimlanadi. Harorat kapillyarga biriktirilgan shkalada o'qiladi (2.5-rasm). Odatda, suyuq termometrlar 125 dan 900 K gacha bo'lgan harorat oralig'ida qo'llaniladi. O'lchangan haroratning pastki chegarasi suyuqlikning xususiyatlari, yuqori qismi - kapillyar shishaning xususiyatlari bilan belgilanadi.
2.6-rasmda ingichka kapillyar bilan tugaydigan kichik simob rezervuaridan tashkil topgan simob termometri ko'rsatilgan. Qizdirilganda simob kengayadi va uning darajasi h kapillyarda ko'tariladi. Haroratning shkalasi va kelib chiqishi erkin tanlanishi mumkin.
|
|
|
|
Shakl - 2.5 |
Shakl - 2.6 |
Xalqaro amaliyotda haroratni o'lchash uchun eng keng tarqalgan shkala hisoblanadi santigrad Selsiy. Bunday holda, muzning erishi harorati normal sharoitda, ya'ni bosim ostida R= 1 atm, va 100 ° uchun - suvning qaynash nuqtasi (bir xil sharoitlarda). Keyin kapillyarning balandligini bo'lish h 100 100 ta teng qismdagi bu ikki nuqta o'rtasida siz haroratni aniqlashingiz mumkin t kapillyardagi simobning ko'tarilish balandligiga nisbatan Selsiy gradusida h t ikkita doimiy nuqta orasidagi intervalgacha, ya'ni.
Haroratni bunday aniqlash kundalik hayotda faqat qo'pol o'lchovlar uchun javob beradi. Aniqroq o'lchovlar bilan. Turli xil termometrik suyuqliklar uchun, masalan, simob va alkogolli termometrlar uchun bir xil haroratda nisbatlarning raqamli qiymatlari aniqlangan. h 1 / h 100 - faqat tanlangan doimiy nuqtalar uchun bir-biriga to'g'ri keladi. Oraliq haroratlarda ikkala termometrning ko'rsatkichlari biroz farq qiladi, chunki turli xil suyuqliklar va ularni o'z ichiga olgan idishlarning kengayish qonunlari boshqacha.
Zamonaviy texnologiyada haroratni o'lchashning elektr usullari eng qulaydir. Deb atalmishda qarshilik termometrlari metallar va yarim o'tkazgichlar qizdirilganda ularning qarshiligini o'zgartirish uchun ishlatiladi. Termoelementlar yoki termojuftlar ikkita metall yoki yarim o'tkazgichning aloqa nuqtasi qizdirilganda paydo bo'ladigan elektromotor kuch o'lchanadi.
Qarshilik termometrlarida termometrik tana metall yoki yarimo'tkazgich bo'lib, uning qarshiligi harorat bilan o'zgaradi. Qarshilikning harorat bilan o'zgarishi ko'prik sxemalari yordamida o'lchanadi (2.7-rasm). Metalllardan qarshilik termometrlari 70 dan 1300 K gacha bo'lgan harorat oralig'ida, yarimo'tkazgichlardan (termistorlar) - 150 dan 400 K gacha va uglerodli termometrlardan - suyuq geliy haroratigacha qo'llaniladi.
Harorat shkalasida haroratni aniqlashning har qanday usuli bilan siz mutlaq qiymatga ega bo'lgan nuqtani belgilashingiz mumkin. Bu nuqta molekulalarning xaotik (termik) harakati bo'lmagan haroratga to'g'ri keladi va deyiladi. mutlaq nol harorat (T= 0 ° C = 0 ° K). Ideal gaz holatida qiymat T= 0 molekulalarning translatsiya harakatining kinetik energiyasining yo'qligi va bosimning yo'qligiga to'g'ri keladi. Haroratni o'lchash uchun bunday shkala mutlaq shkala deb ataladi, o'lchov birligi Kelvin darajasi ( TO). Mutlaq nol haroratda materiya zarralarining barcha harakati to'xtaydi, deb o'ylamaslik kerak. Agar barcha gaz molekulalari to'xtab qolsa ham, ularning ichida elektronlar yadrolar atrofida ma'lum orbitalarda harakat qiladi, ma'lum bir tarzda proton va neytronlar yadro ichidagi harakatda ishtirok etadi. Quyida, masalan, mutlaq nol bo'lgan metalldagi erkin elektronlarning o'rtacha kinetik energiyasi xona haroratidagi gaz molekulalarining o'rtacha kinetik energiyasidan yuzlab marta yuqori ekanligiga ishonch hosil qilamiz.