O fato de todas as isóbaras convergirem em um ponto (Fig. 1.9) não é um acidente, mas um padrão que tem um certo significado físico. Lei de Gay-Lussac não nega a possibilidade de um aumento ilimitado da temperatura, pois o volume de gás com o aumento da temperatura pode aumentar indefinidamente. Porém, à medida que a temperatura diminui, ela tende a zero e tem um limite ( V=0), pois não pode ser negativo.
Na verdade, os gases reais nem conseguem atingir esse limite, pois seus átomos e moléculas, embora pequenos em tamanho, ainda apresentam certo volume.
Se na Eq. (V—V 0) /V 0 =αΔ t, sugerir que V 0 —é o volume de gás em t 0= 0°C, portanto Δ t =t—t 0 =t, e igualá-lo a zero como limite inferior do volume, obtemos o valor da temperatura mais baixa na escala Celsius que os corpos podem ter:
0 = V 0. (1+t/273).
1 + t/273 = 0, t = -273°C
Então, a temperatura pode subir indefinidamente, mas na natureza existe seu limite inferior - zero absoluto, abaixo do qual não pode cair. É por isso que as isóbaras de todos os gases convergem para um ponto no eixo da temperatura, que é -273°C.
Nem tudo no mundo é relativo; Existem também valores absolutos, em particular temperatura zero absoluta.
Existência temperatura zero absoluta foi fundada pelo cientista inglês W. Thomson ( Kelvin) como base para a construção escala de temperatura absoluta, que não depende das propriedades do corpo métrico e, portanto, pode ser considerado ideal. Matéria do site

William Thompson (Lorde Kelvin) (1824 - 1907). Físico inglês, um dos fundadores da termodinâmica e da teoria cinética molecular, da teoria dos fenômenos termoelétricos, dos fundamentos das oscilações eletromagnéticas. Formulou a segunda lei da termodinâmica, introduziu a escala de temperatura absoluta (escala Kelvin), descobriu o efeito termodinâmico, derivou a fórmula para o período de oscilações eletromagnéticas naturais em um circuito oscilatório, realizou cálculos dos tamanhos das moléculas, etc. conquistas científicas recebeu o título de Lord Kelvin.
O ponto de partida da escala é temperatura zero absoluta, cujo valor exato é -273,15° C. A unidade de medida escolhida é o valor que se chama no SI Kelvin(PARA); é do tamanho de um diploma Celsius(°C): 1K = 1°C. Portanto, entre a temperatura absoluta T e temperatura na escala Celsius t existe uma relação simples (Fig. 1.10):
T =t + 273.
Conceito temperatura absolutaé amplamente utilizado em termodinâmica e física molecular, pois possui um significado físico profundo e simplifica a escrita de muitas equações.
Nesta página há material sobre os seguintes temas:
Escala de temperatura termodinâmica zero absoluto abstrato
Palestra escala de temperatura absoluta
Fenômenos termoelétricos e física molecular
-
A temperatura é uma medida quantitativa do “calor” de um corpo. O conceito de temperatura ocupa um lugar especial entre quantidades físicas, determinando o estado do sistema. A temperatura não caracteriza apenas o estado de equilíbrio térmico de um determinado corpo. É também o parâmetro que assume o mesmo valor para quaisquer dois ou mais corpos que estejam em equilíbrio térmico entre si, ou seja, caracteriza o equilíbrio térmico de um sistema de corpos. Isto significa que se dois ou mais corpos com temperaturas diferentes forem colocados em contato, então, como resultado da interação entre as moléculas, esses corpos assumirão o mesmo valor de temperatura.
A teoria cinética molecular permite esclarecer o significado físico da temperatura. Comparando as expressões (2.4) e (2.7), vemos que elas coincidem se colocarmos
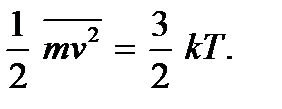 (2.9)
(2.9)Essas relações são chamadas de segundas equações básicas da teoria cinética molecular dos gases. Eles mostram isso temperatura absolutaé uma quantidade que determina a energia cinética média do movimento translacional das moléculas; é uma medida da energia do movimento de translação das moléculas e, portanto, da intensidade do movimento térmico das moléculas. Este é o significado cinético molecular da temperatura absoluta. Como vemos, o processo de aquecimento de um corpo está diretamente relacionado ao aumento da energia cinética média das partículas do corpo. De (2.9) fica claro que a temperatura absoluta é uma quantidade positiva:
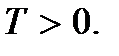 Significado
Significado 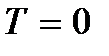 chamada temperatura zero absoluto. De acordo com (2.8), no zero absoluto o movimento de translação das partículas deve parar completamente (
chamada temperatura zero absoluto. De acordo com (2.8), no zero absoluto o movimento de translação das partículas deve parar completamente ( 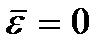 ). Deve-se notar, entretanto, que em baixas temperaturas o gás condensa. Conseqüentemente, todas as conclusões tiradas com base na teoria cinética dos gases perdem o sentido. E na temperatura zero absoluto, o movimento não desaparece. O movimento dos elétrons nos átomos e o movimento dos elétrons livres nos metais são completamente preservados mesmo na temperatura zero absoluto. Além disso, mesmo no zero absoluto, algum movimento vibracional dos átomos dentro das moléculas e dos átomos nos nós de uma rede cristalina é preservado. A existência dessas oscilações está associada à presença de energia do ponto zero no oscilador harmônico quântico (
). Deve-se notar, entretanto, que em baixas temperaturas o gás condensa. Conseqüentemente, todas as conclusões tiradas com base na teoria cinética dos gases perdem o sentido. E na temperatura zero absoluto, o movimento não desaparece. O movimento dos elétrons nos átomos e o movimento dos elétrons livres nos metais são completamente preservados mesmo na temperatura zero absoluto. Além disso, mesmo no zero absoluto, algum movimento vibracional dos átomos dentro das moléculas e dos átomos nos nós de uma rede cristalina é preservado. A existência dessas oscilações está associada à presença de energia do ponto zero no oscilador harmônico quântico ( 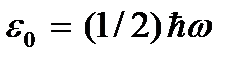 ), que podem ser consideradas as vibrações dos átomos acima. Esta energia não depende da temperatura, o que significa que não desaparece mesmo em
), que podem ser consideradas as vibrações dos átomos acima. Esta energia não depende da temperatura, o que significa que não desaparece mesmo em 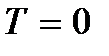 . Em baixas temperaturas, as ideias clássicas sobre o movimento deixam de ser verdadeiras. Nesta área operam leis quânticas, segundo as quais o movimento das partículas não para, mesmo que a temperatura do corpo seja reduzida ao zero absoluto. Mas a velocidade deste movimento já não depende da temperatura e este movimento não é térmico. Isto é confirmado pelo princípio da incerteza. Se as partículas do corpo estivessem em repouso, então suas posições (coordenadas x, sim, z) e impulsos (projeções de impulso p x, p e, p z) seria determinado com precisão
. Em baixas temperaturas, as ideias clássicas sobre o movimento deixam de ser verdadeiras. Nesta área operam leis quânticas, segundo as quais o movimento das partículas não para, mesmo que a temperatura do corpo seja reduzida ao zero absoluto. Mas a velocidade deste movimento já não depende da temperatura e este movimento não é térmico. Isto é confirmado pelo princípio da incerteza. Se as partículas do corpo estivessem em repouso, então suas posições (coordenadas x, sim, z) e impulsos (projeções de impulso p x, p e, p z) seria determinado com precisão 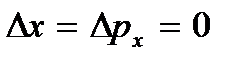 etc., e isso contradiz as relações de incerteza
etc., e isso contradiz as relações de incerteza 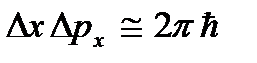 etc. O zero absoluto não é alcançável. Será mostrado a seguir que temperatura zero absoluto significa um estado do sistema em que o sistema está em um estado de menor energia e, portanto, uma diminuição adicional na intensidade do movimento de suas partículas devido à transferência de sua energia para corpos circundantes não é possível.
etc. O zero absoluto não é alcançável. Será mostrado a seguir que temperatura zero absoluto significa um estado do sistema em que o sistema está em um estado de menor energia e, portanto, uma diminuição adicional na intensidade do movimento de suas partículas devido à transferência de sua energia para corpos circundantes não é possível.A fórmula (2.7) pode ser escrita na forma.
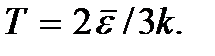
Esta fórmula pode servir como definição do conceito de temperatura absoluta para um gás monoatômico. A temperatura de qualquer outro sistema pode ser definida como um valor igual à temperatura de um gás monoatômico em equilíbrio térmico com este sistema. A determinação da temperatura usando esta fórmula é correta até temperaturas nas quais a probabilidade de ocorrência de estados eletronicamente excitados de átomos de gás não pode mais ser negligenciada.
A relação (2.8) permite-nos introduzir a chamada raiz quadrada média da velocidade quadrada de uma molécula, definindo-a como
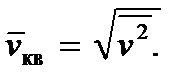
Então obtemos
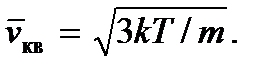
O conceito de temperatura absoluta pode ser introduzido de forma mais estrita na física estatística, onde pode ser considerada como o módulo da distribuição estatística das partículas por energia. Observe também que como a temperatura, assim como a pressão, como pode ser visto nas fórmulas (2.7) e (2.8), é determinada pela energia cinética média de uma molécula de gás ideal, então elas representam quantidades estatísticas e, portanto, não faz sentido fale sobre a temperatura ou pressão de uma ou de um pequeno número de moléculas.
A escolha dos pontos de derretimento do gelo e da água fervente como pontos principais da escala de temperatura é completamente arbitrária. Obtido desta forma escala de temperatura acabou sendo inconveniente para a pesquisa teórica.
Com base nas leis da termodinâmica, Kelvin conseguiu construir a chamada escala de temperatura absoluta (atualmente chamada de escala de temperatura termodinâmica ou escala Kelvin), completamente independente da natureza do corpo termométrico ou do parâmetro termométrico selecionado. Porém, o princípio de construção de tal escala vai além do currículo escolar. Analisaremos esta questão usando outras considerações.
A fórmula (2) implica duas maneiras possíveis de estabelecer uma escala de temperatura: usando uma mudança na pressão de uma certa quantidade de gás a um volume constante ou alterando o volume em pressão constante. Essa escala é chamada escala de temperatura ideal do gás.
A temperatura determinada pela igualdade (2) é chamada temperatura absoluta. Temperatura absoluta? não pode ser negativo, pois obviamente existem quantidades positivas no lado esquerdo da igualdade (2) (mais precisamente, não pode ter sinais diferentes; pode ser positivo ou negativo. Isso depende da escolha do sinal da constante k. Como a temperatura do ponto triplo foi considerada positiva, então a temperatura absoluta só pode ser positiva). Portanto, o menor valor de temperatura possível T = 0 é a temperatura quando a pressão ou volume é zero.
A temperatura limite na qual a pressão de um gás ideal desaparece em um volume fixo ou o volume de um gás ideal tende a zero (ou seja, o gás deve ser comprimido em um “ponto”) a uma pressão constante é chamada zero absoluto. Este é o mais temperatura baixa na natureza.
Da igualdade (3), levando em conta que
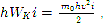
O significado físico do zero absoluto é o seguinte: o zero absoluto é a temperatura na qual o movimento térmico de translação das moléculas deve cessar. O zero absoluto é inatingível.
O Sistema Internacional de Unidades (SI) usa uma escala de temperatura termodinâmica absoluta. O zero absoluto é considerado a temperatura zero nesta escala. O segundo ponto de referência é a temperatura na qual a água, o gelo e o vapor saturado estão em equilíbrio dinâmico, o chamado ponto triplo (na escala Celsius, a temperatura do ponto triplo é 0,01 °C). Cada unidade de temperatura absoluta, chamada Kelvin (simbolizada por 1 K), é igual a um grau Celsius.
= .Qualquer medição requer a presença de um ponto de referência. A temperatura não é exceção. Para a escala Fahrenheit, esta marca zero é a temperatura da neve misturada com sal de cozinha; para a escala Celsius, é a temperatura de congelamento da água. Mas existe um ponto de referência de temperatura especial - zero absoluto.
A temperatura absoluta zero corresponde a 273,15 graus Celsius abaixo de zero, 459,67 abaixo de zero Fahrenheit. Para a escala de temperatura Kelvin, esta temperatura em si é a marca zero.
A essência da temperatura zero absoluta
O conceito de zero absoluto vem da própria essência da temperatura. Qualquer corpo possui energia, que libera para o ambiente externo durante a transferência de calor. Ao mesmo tempo, a temperatura corporal diminui, ou seja, resta menos energia. Teoricamente, esse processo pode continuar até que a quantidade de energia atinja um mínimo tal que o corpo não possa mais distribuí-la.
Um prenúncio distante de tal ideia já pode ser encontrado em M.V. O grande cientista russo explicou o calor pelo movimento “rotativo”. Conseqüentemente, o grau máximo de resfriamento é a parada completa desse movimento.De acordo com os conceitos modernos, a temperatura zero absoluto é um estado da matéria em que as moléculas têm o nível de energia mais baixo possível. Com menos energia, ou seja, a uma temperatura mais baixa, nenhum corpo físico pode existir.
A teoria e a prática
A temperatura zero absoluto é um conceito teórico impossível de ser alcançado na prática, mesmo em laboratórios científicos com os equipamentos mais sofisticados. Mas os cientistas conseguem resfriar a substância a temperaturas muito baixas, próximas do zero absoluto.
Nessas temperaturas, as substâncias adquirem propriedades surpreendentes que não poderiam ter em circunstâncias normais. O mercúrio, que é chamado de “prata viva” por estar em um estado próximo ao líquido, torna-se sólido nessa temperatura – a ponto de poder ser usado para cravar pregos. Alguns metais tornam-se quebradiços, como o vidro. A borracha torna-se igualmente dura e quebradiça. Se você bater em um objeto de borracha com um martelo a uma temperatura próxima do zero absoluto, ele quebrará como vidro.
Esta mudança nas propriedades também está associada à natureza do calor. Quanto maior a temperatura do corpo físico, mais intensas e caóticas as moléculas se movem. À medida que a temperatura diminui, o movimento torna-se menos intenso e a estrutura torna-se mais ordenada. Assim, um gás torna-se líquido e um líquido torna-se sólido. O nível final de ordem é a estrutura cristalina. Em temperaturas ultrabaixas, mesmo substâncias que normalmente permanecem amorfas, como a borracha, adquirem-no.
Fenômenos interessantes também ocorrem com metais. Os átomos da rede cristalina vibram com menos amplitude, o espalhamento de elétrons diminui e, portanto, a resistência elétrica cai. O metal adquire supercondutividade, cuja aplicação prática parece muito tentadora, embora difícil de conseguir.
A temperatura limite na qual o volume de um gás ideal se torna igual a zero é considerada a temperatura zero absoluta. No entanto, o volume dos gases reais à temperatura zero absoluto não pode desaparecer. Esse limite de temperatura faz sentido então?
A temperatura limite, cuja existência decorre da lei de Gay-Lussac, faz sentido, pois é praticamente possível aproximar as propriedades de um gás real das propriedades de um gás ideal. Para isso, é necessário pegar um gás cada vez mais rarefeito, para que sua densidade tenda a zero. Na verdade, à medida que a temperatura diminui, o volume desse gás tenderá ao limite, próximo de zero.
Vamos encontrar o valor do zero absoluto na escala Celsius. Equacionando volume VV fórmula (3.6.4) zero e levando em consideração que
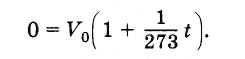
Portanto, a temperatura zero absoluta é
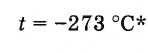
* Valor zero absoluto mais preciso: -273,15 °C.
Esta é a temperatura extrema e mais baixa da natureza, aquele “maior ou último grau de frio”, cuja existência Lomonosov previu.
Escala Kelvin

Kelvin William (Thomson W.) (1824-1907) - um notável físico inglês, um dos fundadores da termodinâmica e da teoria cinética molecular dos gases.
Kelvin introduziu a escala de temperatura absoluta e deu uma das formulações da segunda lei da termodinâmica na forma da impossibilidade de converter completamente calor em trabalho. Ele calculou o tamanho das moléculas com base na medição da energia superficial do líquido. Em conexão com a instalação do cabo telegráfico transatlântico, Kelvin desenvolveu a teoria das oscilações eletromagnéticas e derivou uma fórmula para o período de oscilações livres em um circuito. Por suas realizações científicas, W. Thomson recebeu o título de Lord Kelvin.
O cientista inglês W. Kelvin introduziu a escala de temperatura absoluta. A temperatura zero na escala Kelvin corresponde ao zero absoluto, e a unidade de temperatura nesta escala é igual a um grau na escala Celsius, portanto, temperatura absoluta T está relacionado à temperatura na escala Celsius pela fórmula
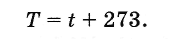 (3.7.6)
(3.7.6)A Figura 3.11 mostra a escala absoluta e a escala Celsius para comparação.
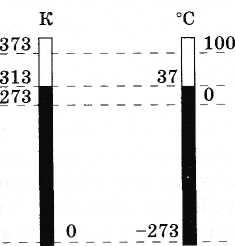
A unidade SI de temperatura absoluta é chamada de Kelvin (abreviado como K). Portanto, um grau na escala Celsius é igual a um grau na escala Kelvin: 1 °C = 1 K.
Assim, a temperatura absoluta, de acordo com a definição dada pela fórmula (3.7.6), é uma quantidade derivada que depende da temperatura Celsius e do valor de a determinado experimentalmente. Contudo, é de fundamental importância.
Do ponto de vista da teoria cinética molecular, a temperatura absoluta está relacionada à energia cinética média do movimento caótico de átomos ou moléculas. No T = OK, o movimento térmico das moléculas para. Isso será discutido com mais detalhes no Capítulo 4.
Dependência do volume da temperatura absoluta
Utilizando a escala Kelvin, a lei de Gay-Lussac (3.6.4) pode ser escrita de uma forma mais simples. Porque
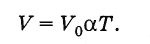 (3.7.7)
(3.7.7)O volume de um gás de determinada massa a pressão constante é diretamente proporcional à temperatura absoluta.
Segue-se que a razão dos volumes de gás da mesma massa em diferentes estados e à mesma pressão é igual à razão das temperaturas absolutas:
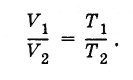 (3.7.8)
(3.7.8)Existe uma temperatura mínima possível na qual o volume (e a pressão) de um gás ideal desaparece. Esta é a temperatura zero absoluta:-273ºC. É conveniente contar a temperatura a partir do zero absoluto. É assim que a escala de temperatura absoluta é construída.




