Le fait que toutes les isobares convergent en un point (Fig. 1.9) n'est pas un accident, mais une régularité qui a une certaine signification physique. Loi de Gay Lussac ne nie pas la possibilité d'une augmentation illimitée de la température, car le volume de gaz avec une augmentation de la température peut augmenter indéfiniment. Néanmoins, avec une diminution de la température, il tend vers zéro et a une frontière ( V = 0), car il ne peut pas être négatif.
En fait, les gaz réels ne peuvent même pas atteindre cette limite, car leurs atomes et molécules, bien que de petite taille, ont encore un certain volume.
Si dans l'équation (V -V 0) /V 0 =αΔ t, suggère que V 0 - c'est le volume de gaz à t 0= 0°C, donc Δ t =t -t 0 =t, et l'assimiler à zéro comme limite inférieure du volume, alors nous obtenons la valeur de la température la plus basse sur l'échelle Celsius que les corps peuvent avoir :
0 = V 0. (1 + t/273).
1 + t / 273 = 0, t = -273°C
Ainsi, la température peut augmenter à l'infini, mais dans la nature, il existe une limite inférieure - zéro absolu, au-dessous duquel il ne peut descendre. C'est pourquoi les isobares de tous les gaz convergent en un point sur l'axe des températures, qui est de -273°C.
Tout dans le monde n'est pas relatif ; il existe aussi des valeurs absolues, en particulier températures zéro absolu.
Existence température zéro absolu a été posée par le scientifique anglais W. Thomson ( Kelvin) dans la base de la construction échelle de température absolue, qui ne dépend pas des propriétés du corps métrique et peut donc être considéré comme idéal. Matériel du site

Guillaume Thomson (Lord Kelvin) (1824 - 1907). Physicien anglais, l'un des fondateurs de la thermodynamique et de la théorie de la cinétique moléculaire, la théorie des phénomènes thermoélectriques, les fondements des oscillations électromagnétiques. Il a formulé la deuxième loi de la thermodynamique, introduit l'échelle de température absolue (échelle de Kelvin), découvert l'effet thermodynamique, dérivé la formule de la période des oscillations électromagnétiques naturelles dans le circuit oscillatoire, effectué des calculs de la taille des molécules, etc. réalisations scientifiques reçu le titre de Lord Kelvin.
Le point de départ de l'échelle est température zéro absolu, dont la valeur exacte est -273,15 ° С.L'unité de mesure est la valeur que l'on appelle en SI kelvin(À); il est de taille égale à un degré Celsius(°C) : 1K = 1°C. Par conséquent, entre la température absolue T et la température sur l'échelle Celsius t il existe une relation simple (Fig. 1.10) :
T =t + 273.
Concept température absolue largement utilisé en thermodynamique et en physique moléculaire, car il a une signification physique profonde et simplifie l'écriture de nombreuses équations.
Sur cette page du matériel sur des sujets :
Échelle de température thermodynamique abstrait zéro absolu
Échelle de température absolue de la conférence
Phénomènes thermoélectriques et physique moléculaire
-
La température est une mesure quantitative de la « chaleur » du corps. La notion de température occupe une place particulière dans la série grandeurs physiques déterminer l'état du système. La température ne caractérise pas seulement l'état d'équilibre thermique d'un corps donné. C'est aussi le paramètre qui prend la même valeur pour deux corps ou plus en équilibre thermique l'un avec l'autre, c'est-à-dire caractérise l'équilibre thermique d'un système de corps. Cela signifie que si deux corps ou plus avec des températures différentes sont mis en contact, alors en raison de l'interaction entre les molécules, ces corps prendront la même valeur de température.
La théorie de la cinétique moléculaire permet de clarifier la signification physique de la température. En comparant les expressions (2.4) et (2.7), on voit qu'elles coïncident si on pose
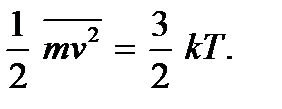 (2.9)
(2.9)Ces relations sont appelées les deuxièmes équations de base de la théorie de la cinétique moléculaire des gaz. Ils montrent que température absolue il existe une quantité qui détermine l'énergie cinétique moyenne du mouvement de translation des molécules ; c'est une mesure de l'énergie du mouvement de translation des molécules, et donc de l'intensité du mouvement thermique des molécules. C'est la signification moléculaire et cinétique de la température absolue. Comme vous pouvez le voir, le processus de chauffage d'un corps est directement lié à une augmentation de l'énergie cinétique moyenne des particules du corps. D'après (2.9), on peut voir que la température absolue est une valeur positive :
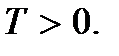 Sens
Sens 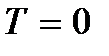 appelée température du zéro absolu. D'après (2.8), au zéro absolu, le mouvement de translation des particules devrait cesser complètement (
appelée température du zéro absolu. D'après (2.8), au zéro absolu, le mouvement de translation des particules devrait cesser complètement ( 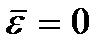 ). Cependant, il convient de noter qu'à basse température, le gaz se transforme en un état condensé. Par conséquent, toutes les conclusions tirées sur la base de la théorie cinétique des gaz perdent également leur sens. Et au zéro absolu de température, le mouvement ne disparaît pas. Le mouvement des électrons dans les atomes, le mouvement des électrons libres dans les métaux sont complètement préservés même à une température de zéro absolu. De plus, même au zéro absolu, un certain mouvement vibratoire des atomes à l'intérieur des molécules et des atomes dans les nœuds du réseau cristallin est préservé. L'existence de ces oscillations est associée à la présence d'énergie nulle dans l'oscillateur harmonique quantique (
). Cependant, il convient de noter qu'à basse température, le gaz se transforme en un état condensé. Par conséquent, toutes les conclusions tirées sur la base de la théorie cinétique des gaz perdent également leur sens. Et au zéro absolu de température, le mouvement ne disparaît pas. Le mouvement des électrons dans les atomes, le mouvement des électrons libres dans les métaux sont complètement préservés même à une température de zéro absolu. De plus, même au zéro absolu, un certain mouvement vibratoire des atomes à l'intérieur des molécules et des atomes dans les nœuds du réseau cristallin est préservé. L'existence de ces oscillations est associée à la présence d'énergie nulle dans l'oscillateur harmonique quantique ( 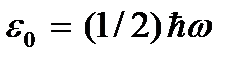 ), qui peuvent être considérées comme les vibrations susmentionnées des atomes. Cette énergie ne dépend pas de la température, ce qui signifie qu'elle ne disparaît pas même à
), qui peuvent être considérées comme les vibrations susmentionnées des atomes. Cette énergie ne dépend pas de la température, ce qui signifie qu'elle ne disparaît pas même à 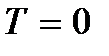 ... A basse température, les concepts classiques du mouvement cessent d'être remplis. Dans ce domaine, des lois quantiques fonctionnent, selon lesquelles le mouvement des particules ne s'arrête pas, même si la température du corps est abaissée au zéro absolu. Mais la vitesse de ce mouvement ne dépend plus de la température et ce mouvement n'est pas thermique. Ceci est confirmé par le principe d'incertitude. Si les particules du corps étaient au repos, alors leurs positions (coordonnées X, oui, z) et des impulsions (projections d'impulsion px, p y, p z) serait précisément défini
... A basse température, les concepts classiques du mouvement cessent d'être remplis. Dans ce domaine, des lois quantiques fonctionnent, selon lesquelles le mouvement des particules ne s'arrête pas, même si la température du corps est abaissée au zéro absolu. Mais la vitesse de ce mouvement ne dépend plus de la température et ce mouvement n'est pas thermique. Ceci est confirmé par le principe d'incertitude. Si les particules du corps étaient au repos, alors leurs positions (coordonnées X, oui, z) et des impulsions (projections d'impulsion px, p y, p z) serait précisément défini 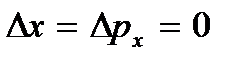 etc., ce qui contredit les relations d'incertitude
etc., ce qui contredit les relations d'incertitude 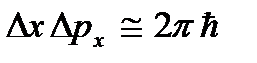 etc. Le zéro absolu n'est pas réalisable. Il sera montré ci-dessous que la température du zéro absolu signifie un état du système dans lequel le système est dans un état avec la plus faible énergie, et donc une nouvelle diminution de l'intensité du mouvement de ses particules en raison du transfert de son énergie à l'environnement. corps n'est pas possible.
etc. Le zéro absolu n'est pas réalisable. Il sera montré ci-dessous que la température du zéro absolu signifie un état du système dans lequel le système est dans un état avec la plus faible énergie, et donc une nouvelle diminution de l'intensité du mouvement de ses particules en raison du transfert de son énergie à l'environnement. corps n'est pas possible.La formule (2.7) peut s'écrire sous la forme.
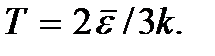
Cette formule peut servir de définition du concept de température absolue pour un gaz monoatomique. La température de tout autre système peut être définie comme une valeur égale à la température d'un gaz monoatomique en équilibre thermique avec ce système. La détermination de la température à l'aide de cette formule est correcte jusqu'à des températures auxquelles la probabilité d'apparition d'états excités électroniquement des atomes de gaz ne peut plus être négligée.
La relation (2.8) nous permet d'introduire la vitesse dite quadratique moyenne d'une molécule, la définissant comme
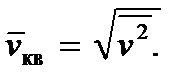
Ensuite, nous obtenons
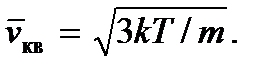
Le concept de température absolue peut être introduit plus rigoureusement en physique statistique, où il peut être considéré comme le module de la distribution statistique d'énergie des particules. Nous notons également que puisque la température, ainsi que la pression, comme on peut le voir à partir des formules (2.7) et (2.8), est déterminée par l'énergie cinétique moyenne d'une molécule de gaz parfait, alors les toni sont des quantités statistiques et, par conséquent , cela n'a aucun sens de parler de la température ou de la pression d'une ou d'un petit nombre de molécules.
Le choix des points de fonte de la glace et d'ébullition de l'eau comme points principaux de l'échelle de température est complètement arbitraire. Ainsi obtenu échelle de température s'est avéré peu pratique pour la recherche théorique.
Sur la base des lois de la thermodynamique, Kelvin a réussi à construire l'échelle dite de température absolue (on l'appelle maintenant l'échelle de température thermodynamique ou l'échelle de Kelvin), complètement indépendante soit de la nature du corps thermométrique, soit du paramètre thermométrique choisi. Cependant, le principe de construction d'une telle échelle dépasse le programme scolaire. Nous examinerons cette question en utilisant d'autres considérations.
A partir de la formule (2), deux manières possibles d'établir l'échelle de température découlent : l'utilisation d'un changement de la pression d'une certaine quantité de gaz à un volume constant ou un changement de volume à pression constante... Cette échelle est appelée échelle de température des gaz parfaits.
La température définie par l'égalité (2) est appelée température absolue... Température absolue? ne peut pas être négatif, puisqu'à gauche dans l'égalité (2) il y a évidemment des valeurs positives (plus précisément, il ne peut pas avoir de signes différents, il peut être soit positif soit négatif. Cela dépend du choix du signe de la constante k Puisque la température du point triple a été convenue est considérée comme positive, alors la température absolue ne peut être que positive). Par conséquent, la plus petite valeur de température possible T = 0 est la température lorsque la pression ou le volume est nul.
La température limite à laquelle la pression d'un gaz parfait s'évanouit à un volume fixe ou le volume d'un gaz parfait tend vers zéro (c'est-à-dire que le gaz doit, pour ainsi dire, être comprimé en un "point") à une pression constante , est appelé zéro absolu... C'est le plus basse température dans la nature.
A partir de l'égalité (3), en tenant compte du fait que
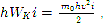
la signification physique du zéro absolu suit : le zéro absolu est la température à laquelle le mouvement de translation thermique des molécules doit s'arrêter. Le zéro absolu est inaccessible.
Le Système international d'unités (SI) utilise une échelle de température thermodynamique absolue. Le zéro absolu est pris comme température zéro sur cette échelle. Le deuxième point de référence est la température à laquelle l'eau, la glace et la vapeur saturée sont en équilibre dynamique, ce qu'on appelle le point triple (sur l'échelle Celsius, la température du point triple est de 0,01°C). Chaque unité de température absolue, appelée Kelvin (notée 1 K), est égale à un degré Celsius.
= .Toute mesure suppose un point de référence. La température ne fait pas exception. Pour l'échelle Fahrenheit, ce zéro est la température de la neige mélangée au sel de table, pour l'échelle Celsius, le point de congélation de l'eau. Mais il existe un point de référence spécial pour la température - le zéro absolu.
La température absolue zéro correspond à 273,15 degrés Celsius en dessous de zéro, 459,67 degrés en dessous de zéro Fahrenheit. Pour l'échelle de température Kelvin, cette température est elle-même un point zéro.
L'essence de la température zéro absolu
Le concept de zéro absolu vient de l'essence même de la température. Tout corps a de l'énergie qu'il cède à l'environnement extérieur lors du transfert de chaleur. Dans le même temps, la température corporelle diminue, c'est-à-dire il reste moins d'énergie. Théoriquement, ce processus peut se poursuivre jusqu'à ce que la quantité d'énergie atteigne un tel minimum, auquel le corps ne peut plus la donner.
Une préfiguration lointaine d'une telle idée se trouve déjà dans M.V. Lomonosov. Le grand scientifique russe a expliqué la chaleur par le mouvement "rotatif". Par conséquent, le degré limite de refroidissement est un arrêt complet d'un tel mouvement.Selon les concepts modernes, le zéro absolu est un état de la matière dans lequel les molécules ont le niveau d'énergie le plus bas possible. Avec moins d'énergie, c'est-à-dire à une température plus basse, aucun corps physique ne peut exister.
Théorie et pratique
Le zéro absolu est un concept théorique, il est impossible de l'atteindre en pratique en principe, même dans les laboratoires scientifiques dotés des équipements les plus sophistiqués. Mais les scientifiques parviennent à refroidir la matière à des températures très basses, proches du zéro absolu.
À de telles températures, les substances acquièrent des propriétés étonnantes qu'elles ne peuvent pas avoir dans des circonstances normales. Le mercure, appelé « argent vivant » en raison de son état quasi liquide, devient solide à cette température - au point de pouvoir enfoncer des clous. Certains métaux deviennent cassants comme le verre. Le caoutchouc devient tout aussi dur et cassant. Si vous frappez un objet en caoutchouc avec un marteau à une température proche du zéro absolu, il se brisera comme du verre.
Ce changement de propriétés est également associé à la nature de la chaleur. Plus la température du corps physique est élevée, plus le mouvement des molécules est intense et chaotique. Au fur et à mesure que la température diminue, le mouvement devient moins intense et la structure devient plus ordonnée. Ainsi, le gaz devient liquide et le liquide devient solide. Le niveau limitant de l'ordre est la structure cristalline. À des températures ultra-basses, il est acquis même par des substances qui, à l'état habituel, restent amorphes, par exemple le caoutchouc.
Des phénomènes intéressants se produisent également avec les métaux. Les atomes du réseau cristallin vibrent avec moins d'amplitude, la diffusion des électrons diminue, donc la résistance électrique chute. Le métal acquiert une supraconductivité, dont l'application pratique semble être très tentante, bien que difficile à réaliser.
La température limite à laquelle le volume d'un gaz parfait devient nul est considérée comme la température du zéro absolu. Cependant, le volume de gaz réels à la température du zéro absolu ne peut pas disparaître. Cette limite de température a-t-elle un sens alors ?
La température limite, dont l'existence découle de la loi de Gay-Lussac, a du sens, puisqu'en pratique il est possible de rapprocher les propriétés d'un gaz réel des propriétés d'un gaz idéal. Pour ce faire, il faut prendre un gaz de plus en plus raréfié pour que sa densité tende vers zéro. Dans un tel gaz, en effet, le volume à température décroissante tendra vers la limite, proche de zéro.
Trouvez la valeur du zéro absolu sur l'échelle Celsius. Volume égal Vv formule (3.6.4) à zéro et en tenant compte du fait que
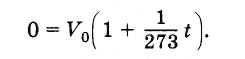
Par conséquent, le zéro absolu de la température est
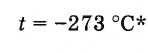
* Valeur plus précise du zéro absolu : -273,15 ° С.
C'est la température extrême, la plus basse de la nature, ce "plus grand ou dernier degré de froid", dont Lomonosov a prédit l'existence.
Échelle Kelvin

Kelvin William (Thomson W.) (1824-1907) - un physicien anglais exceptionnel, l'un des fondateurs de la thermodynamique et de la théorie de la cinétique moléculaire des gaz.
Kelvin a introduit une échelle de température absolue et a donné l'une des formulations de la deuxième loi de la thermodynamique sous la forme de l'impossibilité de convertir complètement la chaleur en travail. Il a calculé la taille des molécules en se basant sur la mesure de l'énergie de surface du liquide. Dans le cadre de la pose du câble télégraphique transatlantique, Kelvin a développé la théorie des oscillations électromagnétiques et a dérivé une formule pour la période d'oscillations libres dans le circuit. Pour ses mérites scientifiques, W. Thomson a reçu le titre de Lord Kelvin.
Le scientifique anglais W. Kelvin a introduit une échelle de température absolue. La température zéro sur l'échelle Kelvin correspond au zéro absolu, et l'unité de température sur cette échelle est égale aux degrés Celsius, donc la température absolue T est lié à la température sur l'échelle Celsius par la formule
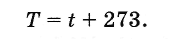 (3.7.6)
(3.7.6)La figure 3.11 montre l'échelle absolue et l'échelle Celsius à des fins de comparaison.
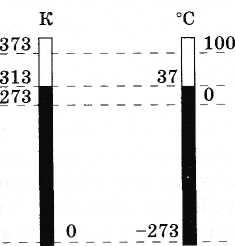
L'unité de température absolue en SI s'appelle le kelvin (en abrégé K). Par conséquent, un degré sur l'échelle Celsius est égal à un degré sur l'échelle Kelvin : 1 °C = 1 K.
Ainsi, la température absolue, selon la définition donnée par la formule (3.7.6), est une valeur dérivée qui dépend de la température Celsius et de la valeur expérimentalement déterminée de a. Cependant, il est d'une importance fondamentale.
Du point de vue de la théorie de la cinétique moléculaire, la température absolue est liée à l'énergie cinétique moyenne du mouvement chaotique des atomes ou des molécules. À T =О К le mouvement thermique des molécules s'arrête. Ceci est discuté plus en détail dans le chapitre 4.
Volume par rapport à la température absolue
En utilisant l'échelle Kelvin, la loi de Gay-Lussac (3.6.4) peut être écrite sous une forme plus simple. Parce que
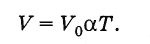 (3.7.7)
(3.7.7)Le volume d'un gaz d'une masse donnée à pression constante est directement proportionnel à la température absolue.
D'où il s'ensuit que le rapport des volumes de gaz de même masse dans différents états à la même pression est égal au rapport des températures absolues :
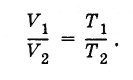 (3.7.8)
(3.7.8)Il existe une température minimale possible à laquelle le volume (et la pression) d'un gaz parfait disparaissent. C'est la température du zéro absolu :-273°C Il est pratique de lire la température à partir du zéro absolu. C'est ainsi que l'échelle de température absolue est construite.




